У робочих зошитах записуємо дату, тему уроку.
Все, що виділено червоним кольором необхідно записати. Малюнки та таблиці за необхідності записати (це буде вказано).
З 24.05.20. результати проектів, практичних робіт, тести, розв'язок задач НЕ ПРИЙМАЮТЬСЯ.
18.03.20.
20.03.20.
Запишіть схеми:
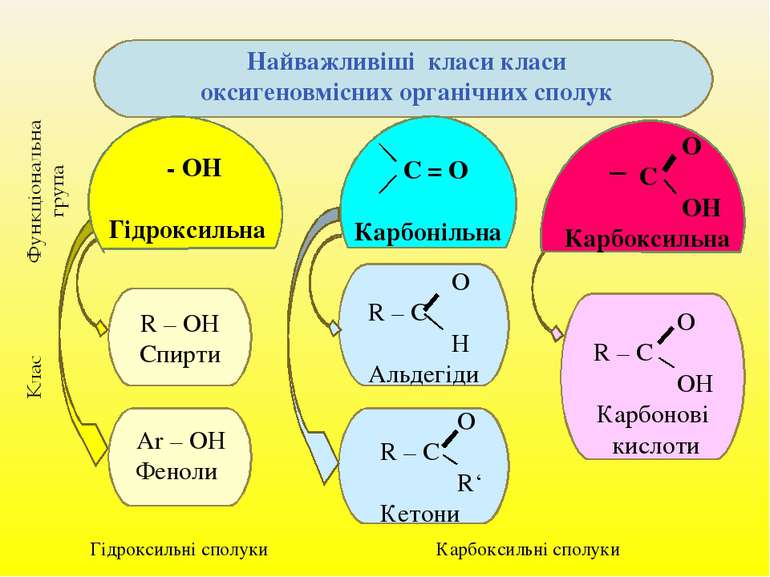

01.04.20.
08.04.20
ТЕМА:Каучуки, гума. Синтетичні волокна.
Параграф №30, 31






























































З 24.05.20. результати проектів, практичних робіт, тести, розв'язок задач НЕ ПРИЙМАЮТЬСЯ.
З 24.05.20. результати проектів, практичних робіт, тести, розв'язок задач НЕ ПРИЙМАЮТЬСЯ.
18.03.20.
ТЕМА: Розв’язування експериментальних задач.
Параграф №21, 22: виконати завдання № 1,8,9,15,18,25,26,29.20.03.20.
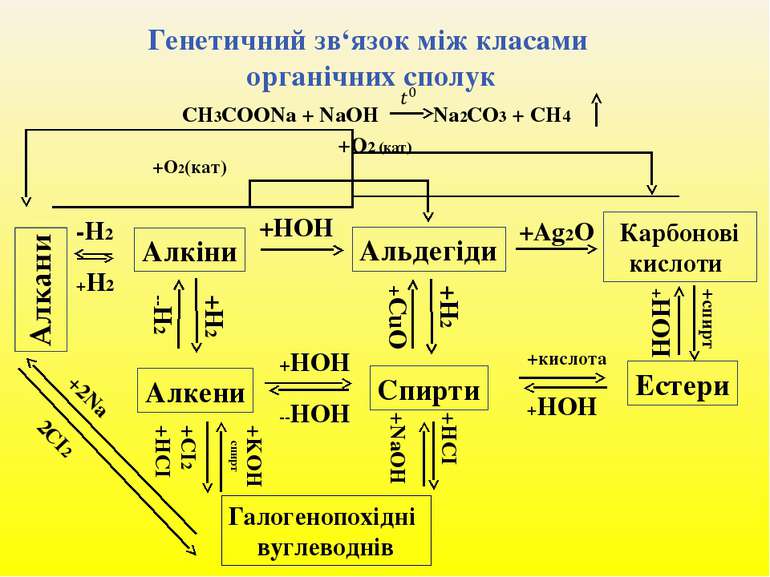
ТЕМА: Генетичні зв’язки між оксигеновмісними органічними сполуками. Виконання тренувальних вправ та розв’язання розрахункових задач.
Запишіть схеми:


1. Речовину А одержують за схемою:

Ця речовина:
а) оцтова кислота; б) бензен;
в) амінооцтова кислота; г) хлороцтова кислота.
2. За наведеною схемою перетворень напишіть і вкажіть номер
перетворення, у результаті якого відбувається взаємодія органічної сполуки
з хлороводнем:
етан → хлоретан → етанол → етаналь → етанова кислота → хлоретанова кислота → →аміноетанова кислота
01.04.20.
ТЕМА: Значення та застосування оксигеновмісних органічних речовин і їхній вплив на довкілля. Захист навчальних проектів.
Застосування спиртів.
Метанол застосовують як розчинник або сировину для одержання
формальдегіду, деяких барвників, фотореактивів, фармацевтичних препаратів.
Ацетальдегід застосовують для виробництва оцтової кислоти, а також
у деяких органічних синтезах.
Оцтова кислота застосовується для добування пластмас, барвників,
ліків, штучних волокон, кіноплівки в хімічних синтезах. Вона використовується
як приправа до їжі, для консервації овочів. Солі оцтової кислоти використовують
для фарбування тканин, а також для боротьби зі шкідниками сільського
господарства.
Глюкоза — цінна поживна речовина. Їжа людини складається приблизно на 70 % з
вуглеводів.
Із целюлози складаються стінки рослинних клітин. У деревині
міститься до 60 % целюлози, у ваті й фільтрувальному папері — до 90 %.
У великих кількостях крохмаль переробляється на декстрини,
патоку і глюкозу, які використовуються в кондитерському виробництві. Із
крохмалю добувають етанол, у медицині на його основі готують мазі, присипки
тощо.
Целюлоза у вигляді бавовни, льону, пеньки йде на виготовлення
тканин, велика її кількість витрачається на виробництво паперу. Гідролізуючи
целюлозу, а потім зброджуючи одержану глюкозу, добувають гідролізний етанол.
Глюкоза, добута з целюлози, служить кормом для худоби. Унаслідок термічного
розкладу целюлози утворюється метанол, деревне вугілля та інші сполуки. Із
целюлози одержують штучний шовк, пластмаси, кіноплівку, бездимний порох, лаки.
Теми навчальних проектів (обрати одну):
11. Екологічна безпечність
застосування і одержання фенолу.
18. Біодизельне пальне.
Проект необхідно зробити у вигляді презентації та надіслати на електронну пошту
narina0596@gmail.com
Метанол застосовують як розчинник або сировину для одержання формальдегіду, деяких барвників, фотореактивів, фармацевтичних препаратів.
Ацетальдегід застосовують для виробництва оцтової кислоти, а також у деяких органічних синтезах.
Оцтова кислота застосовується для добування пластмас, барвників, ліків, штучних волокон, кіноплівки в хімічних синтезах. Вона використовується як приправа до їжі, для консервації овочів. Солі оцтової кислоти використовують для фарбування тканин, а також для боротьби зі шкідниками сільського господарства.
Глюкоза — цінна поживна речовина. Їжа людини складається приблизно на 70 % з вуглеводів.
Із целюлози складаються стінки рослинних клітин. У деревині міститься до 60 % целюлози, у ваті й фільтрувальному папері — до 90 %.
Застосування крохмалю й
целюлози.
У великих кількостях крохмаль переробляється на декстрини, патоку і глюкозу, які використовуються в кондитерському виробництві. Із крохмалю добувають етанол, у медицині на його основі готують мазі, присипки тощо.
Целюлоза у вигляді бавовни, льону, пеньки йде на виготовлення тканин, велика її кількість витрачається на виробництво паперу. Гідролізуючи целюлозу, а потім зброджуючи одержану глюкозу, добувають гідролізний етанол. Глюкоза, добута з целюлози, служить кормом для худоби. Унаслідок термічного розкладу целюлози утворюється метанол, деревне вугілля та інші сполуки. Із целюлози одержують штучний шовк, пластмаси, кіноплівку, бездимний порох, лаки.
У великих кількостях крохмаль переробляється на декстрини, патоку і глюкозу, які використовуються в кондитерському виробництві. Із крохмалю добувають етанол, у медицині на його основі готують мазі, присипки тощо.
Целюлоза у вигляді бавовни, льону, пеньки йде на виготовлення тканин, велика її кількість витрачається на виробництво паперу. Гідролізуючи целюлозу, а потім зброджуючи одержану глюкозу, добувають гідролізний етанол. Глюкоза, добута з целюлози, служить кормом для худоби. Унаслідок термічного розкладу целюлози утворюється метанол, деревне вугілля та інші сполуки. Із целюлози одержують штучний шовк, пластмаси, кіноплівку, бездимний порох, лаки.
Теми навчальних проектів (обрати одну):
11. Екологічна безпечність
застосування і одержання фенолу.
12. Виявлення фенолу в
екстракті зеленого чаю або гуаші.
13. Вуглеводи
у харчових продуктах: виявлення і біологічне значення.
15. Натуральні волокна рослинного походження: їхні
властивості, дія на організм людини, застосування.
16. Штучні волокна: їхнє
застосування у побуті та промисловості.
17. Етери та естери в
косметиці.
|
18. Біодизельне пальне.
Проект необхідно зробити у вигляді презентації та надіслати на електронну пошту
narina0596@gmail.com
08.04.20
ТЕМА:Каучуки, гума. Синтетичні волокна.
Параграф №30, 31
Серед полімерів окремо виділяють групу речовин, які називають еластомерами, або каучуками.
• Еластомери (каучуки) — це природні або синтетичні високомолекулярні сполуки, що відрізняються від інших полімерів високою еластичністю, водонепроникністю.
Молекули каучуків зазвичай скручені в клубки. Під час розтягування молекули витягуються, а після зняття зовнішнього навантаження — скручуються. Цим пояснюється еластичність каучуків.
Натуральний каучук був уперше описаний французьким астрономом та мандрівником Шарлем Марі де ла Кондоміном 1751 року. У мандрівці Південною Америкою він побачив як індіанці збирають молочний сік з дерев (гевея бразильська) і на вогнищі перетворюють його на еластичний матеріал — натуральний каучук.

Збирання молочного соку (латексу) з гевеї
Молочний сік бразильської гевеї та інших каучуконосних рослин (кок-сагизу, крим-сагизу або кульбаби осінньої тощо), який ще називають латексом, містить у складі полімер ізопрену. Під час нагрівання або іншої обробки цей полімер вивільнюється й утворює натуральний каучук.
Натуральний (природний) каучук — це високомолекулярна ненасичена сполука з відносною молекулярною масою 15 000-500 000, мономером якої є дієновий вуглеводень 2-метилбута-1,3-дієн С5Н8. Тривіальна назва цієї сполуки — ізопрен.

Сергій Васильович Лебедєв (1874-1934)
Розробив дешевий спосіб виробництва каучуку.
Із розвитком автомобільної промисловості потреба в каучуку, з якого виготовляли шини, стрімко зростала. Виробництво натурального каучуку не могло задовольнити всі потреби, і постало завдання добути каучук синтетичний. Уперше синтетичний бутадієновий каучук полімеризацією бутадієну добув 1910 року С. В. Лебедєв, який згодом став одним із засновників промислового синтезу каучуків. Синтетичний каучук став промислово вигідним після винайдення способу добувати бутадієн з етанолу пропусканням спирту над каталізатором (реакція Лебедєва) записати:

Синтез каучуків ще значно здешевів після винайдення каталізаторів Циглера — Натти.
Більша частина натурального та синтетичного каучуків витрачається на виробництво автомобільних, авіаційних та велосипедних шин. Латекс і натуральний каучук використовують у виробництві медичних засобів (еластичний бинт, хірургічні рукавички, катетери тощо), а також гумок для стирання, повітряних кульок, деяких видів взуття, презервативів, сосок (пустушок) тощо.
Залежно від будови макромолекул, умов проведення полімеризації та мономерів розрізняють декілька видів каучуків.
Найважливіші види каучуків
Назва
|
Мономер
|
Особливі властивості, застосування
|
Бутадієновий
|
Бута-1,3-дієн*
|
Водо- та газонепроникний, відносно низька пластичність, міцність, морозостійкість. Виготовляють ізоляційні покриття, взуття, побутові гумові вироби
|
Дивініловий
|
Бута-1,3-дієн*
|
За еластичністю подібний до натурального каучуку, за зносостійкістю перевершує його, але поступається за електроізоляційними властивостями. Застосовують переважно у виробництві шин
|
Ізопреновий
|
Ізопрен (2-метилбута-1,3-дієн)
|
За властивостями подібний до натурального каучуку. Виготовляють шини, шланги, ізоляцію для електричних кабелів тощо
|
Хлоропреновий
|
Хлоропрен (2-хлоробута-1,3-дієн)
|
Стійкий до дії високих і низьких температур, бензинів та мастил. Виробництво кабелів, шлангів, трубопроводів для транспортування бензину й нафти
|
* Хоча мономер однаковий, але каучуки відрізняються просторовою будовою.
Матеріали на основі каучуків. Вулканізація. Гума
Натуральний каучук та його синтетичні аналоги мають певні недоліки. Вироби з них недостатньо міцні, їхня еластичність проявляється у невеликому інтервалі температур: за низької температури взимку вони стають надто твердими та розтріскуються, а за високої температури влітку — розм'якшуються та перетворюються на липку масу.
Для усунення недоліків каучуки піддають процесу вулканізації. Вулканізація — технологічний процес хімічної взаємодії каучуків з певним вулканізуючим агентом, частіше сіркою, а також пероксидами та оксидами металічних елементів тощо. Під час вулканізації відбувається «зшивання» молекул каучуку в єдину просторову тривимірну сітку, завдяки чому каучук стає міцнішим та еластичнішим, зменшується його розчинність (мал. 34.2).

Мал. 34.2. Під час вулканізації сіркою макромолекули каучуку «зшиваються» у тривимірну сітку
Під час вулканізації до каучуків додають також наповнювачі, стабілізатори, пластифікатори тощо. Автомобільні шини мають чорний колір саме внаслідок додавання до каучуку сажі. У такий спосіб досягають світлостабільності отриманого матеріалу: сонячне світло поглинається сажею, а не каучуком, молекули якого руйнуються під дією сильного освітлення.
Вулканізацією каучуку добувають різні види гуми:
• м'яку гуму (містить 1-3 % сірки);
• напівтверду гуму (містить 10-15 % сірки);
• тверду гуму, або ебоніт (містить 30-50 % сірки).
М'яка та напівтверда гуми — еластичні матеріали. На відміну від них ебоніт (від грец. ebenos — чорне дерево) не виявляє еластичності. Він досить твердий і піддається механічній обробці. Сьогодні ебоніт зазвичай використовують лише як замінник дорогих матеріалів (чорного дерева, рогу тощо) для виготовлення перових ручок, гребінців, рукояток ножів, мундштуків духових музичних інструментів, прикрас тощо (мал. 34.3).

Мал. 34.3. Вироби з ебоніту
Процес вулканізації також використовують для ремонту автомобільних шин. Сирий каучук дуже еластичний та липне до предметів. Латочку з нього накладають на прокол у камері та піддають вулканізації, після чого пробоїна затягується і зникає (мал. 34.4).

Мал. 34.4. Накладання латочки з каучуку на пробоїну автомобільної камери для вулканізації
Процес вулканізації 1839 року винайшов та запатентував американський винахідник Чарльз Гуд'їр і назвав його на честь давньоримського бога вогню — Вулкана.
Волокнами називають матеріали, що складаються з довгих і тонких ниток або відрізків ниток, придатних для виготовлення пряжі й тканин. За походженням волокна поділяють на натуральні й хімічні.
ХІМІЧНІ ВОЛОКНА. Класифікацію хімічних волокон здійснюють за походженням сировини, з якої їх виробляють.
Запишіть схему:
Якщо сировиною для виробництва хімічного волокна є природний полімер, волокно називають штучним. Якщо ж сировиною є продукти органічного синтезу, то й хімічне волокно називають синтетичним.
Ознайомтеся з класифікацією волокон і прикладами, скориставшись малюнком.

СИНТЕТИЧНІ ВОЛОКНА. Це теж хімічні волокна, але для їхнього виробництва не використовується натуральна (природна) сировина. З продуктів переробки нафти, кам'яного вугілля, природного газу спершу добувають полімер, який далі перетворюють на волокно, а термостійкі полімери просто розплавляють.
Синтетичні волокна виробляють з органічних сполук, здійснюючи хімічні реакції. До цих волокон належать поліпропіленове, полівінілхлоридне, поліестерні та ін. Вони переважають природні волокна за міцністю, еластичністю, довговічністю, не руйнуються мікроорганізмами. Недоліки синтетичних волокон — низька гігроскопічність, здатність до електризації. З метою їх подолання до синтетичних волокон додають природні, а також речовини-антистатики.
Лавсан — поліестерне волокно. Воно нагадує вовну, але є міцнішим. Вироби із цього волокна не потребують прасування.

Тканини з лавсану
Лавсан — термостійкий, погано загоряється й не обвуглюється, не розчиняється в органічних розчинниках, але руйнується кислотами і лугами. Нитки із цього волокна мають низьку гігроскопічність. Тому при виготовленні тканин їх часто змішують з бавовняними, лляними або вовняними нитками.

Нитки і краватки з поліестеру
Поліестерне волокно використовують для виготовлення бензино- й нафтостійких шлангів, канатів, риболовних тралів, електроізоляційних матеріалів, вітрил, декоративних тканин, штучного хутра, ковдр, а також у виробництві шин.
Капрон і найлон — поліамідні волокна. Вони міцні, витримують низькі температури, є хімічно стійкими (руйнуються лише концентрованими неорганічними кислотами), легко забарвлюються. Капронові нитки використовують для виготовлення канатів, риболовних сіток, різних тканин. Найлонове волокно додають до інших волокон; його застосовують у виробництві ковроліну, спортивного одягу.

Нитки і тканина з капрону
Сторінка ерудита
Кевлар (поліпарафенілентерефталамід) — синтетичне волокно високої механічної й термічної міцності, склад якого передає наведена формула.
Його розробником є американська хімік і винахідник Стефані Кволек (1923-2014).
Це легкий і міцний (в 5 разів міцніше сталі), нешкідливий для здоров'я людини, стійкий до перепадів температур матеріал. З нього виготовляють куленепробивні бронежилети і шоломи — засоби індивідуального захисту військовослужбовців і поліцейських, негорючий одяг пожежників. Кевларова тканина також стійка до дії органічних розчинників. Під впливом низьких температур міцність кевларової тканини зростає, проте сонячні промені й волога роблять волокно менш міцним, тому його покривають спеціальним захисним шаром.

10.04.20.
ТЕМА: Насичені й ароматичні аміни.
Параграф № 23, виконати завдання №4,5.

На схемі наведено формули найпростішого аміну, амінооцтової кислоти, фрагмента молекули білка.
Аміни — нітрогеновмісні органічні речовини, похідні амоніаку, молекули яких складаються з вуглеводневого залишку й характеристичної аміногрупи —NH2.
Структурну формулу молекули найпростішого за складом аміну CH3-NH2 можна отримати, замінивши атом Гідрогену в молекулі амоніаку NH3 на групу атомів -СН3:

Модель молекули амоніаку NH3 (синя кулька — атом Нітрогену)
Група атомів -NH2 є характеристичною; її назва — аміногрупа. Загальна формула сполук, у молекулах яких вуглеводневий залишок сполучений з аміногрупою1, — R-ΝΗ2.
Залежно від будови вуглеводневих залишків та особливостей хімічного зв’язку в них розрізняють наступні запишіть схему:
Для того щоб назвати насичений первинний амін з розгалуженим вуглеводневим замісником, дотримуються таких правил.
1. Обирають головний (найдовший) карбоновий ланцюг, у якому один з атомів Карбону сполучений з аміногрупою.
2. Нумерують головний ланцюг за принципом найменшого локанта аміногрупи.
3. З'ясовують наявність у головному ланцюзі вуглеводневих замісників і їх назви.
4. Складають назву речовини в такій послідовності:
- називають в алфавітному порядку вуглеводневі замісники (у разі їх наявності в головному ланцюзі), указуючи перед назвами їх локанти, які виділяють дефісами. До однакових замісників уживають множинні префікси ди-, три-, тетра-;
- називають алкан головного ланцюга;
- після назви головного ланцюга записують, виділяючи з обох боків дефісами, локант аміногрупи;
- додають назву класу цих сполук — «амін».
Наприклад, за систематичною номенклатурою амін зі структурною формулою

має назву 3-етил-4-метилгексан-1-амін.
Насичені аміни. У молекулі насиченого аміну аміногрупа сполучена із залишком молекули алкану. Загальна формула таких речовин — CnH2n+1NH2.
Хімічні властивості насичених амінів запишіть:
АНІЛІН. СКЛАД І БУДОВА МОЛЕКУЛИ. У разі якщо аміногрупа сполучена з бензеновим ядром, то утворюється ароматичний амін феніламін, або анілін :

, або скорочено С6Н5—NH2.
За фізичними властивостями анілін — безбарвна оліїста рідина, малорозчинна у воді.
ХІМІЧНІ ВЛАСТИВОСТІ АНІЛІНУ. Порівняно з метанаміном анілін дуже слабка основа, що не діє на індикатори.
Для аніліну характерні дві групи реакцій: за участю аміногрупи (приклад 1) і за участю бензенового кільця (приклад 2).
1. Взаємодія аніліну з хлоридною кислотою.

2. Взаємодія аніліну з бромною водою. Вам відомо, що бензен не реагує з бромною водою. Але подібно до фенолу анілін за участю бензенового кільця вступає в реакцію заміщення з бромною водою, внаслідок чого утворюється 2,4,6-трибромоанілін (2,4,6-трибромофеніламін) — жовтувато-білий осад (мал. 35).

Мал. 35. Ілюстрація взаємодії аніліну з бромною водою
Заміщення Гідрогену бензенового кільця в трьох положеннях є результатом впливу аміногрупи на бензенове кільце.
ДОБУВАННЯ АНІЛІНУ. У промисловості анілін добувають відновленням нітробензену С6Н5 — NO2 за допомогою водню у присутності нікелевого чи мідного каталізаторів за нагрівання:
Нітробензен добувають з бензену. Нижче наведено схему цих перетворень:

ЗАСТОСУВАННЯ АНІЛІНУ. Понад 150 років анілін виробляють у великій кількості, тому що ця речовина — основа синтезу анілінових барвників, які використовують для фарбування тканин у різні яскраві кольори .

Анілінові барвники
Анілінові барвники можна придбати у вигляді порошку або рідини й за потреби використати в домашніх умовах.
Водночас у разі перевищення допустимих норм використання, вплив аніліну та його похідних для довкілля негативний.
Анілін — сировина для синтезу ліків, наприклад стрептоциду, який має ефективну антимікробну дію; фунгіцидів (препаратів для боротьби з грибковими захворюваннями рослин) та ін.
15.04.20.
ТЕМА: Амінокислоти.
Параграф №24 виконати завдання №2,3.
Амінокислоти — це органічні кислоти, що містять одну чи кілька аміногруп. Наявність у молекулах амінокислот аміногрупи —NH2 та карбоксильної групи —COOH визначає їхні властивості як амінів і кислот. Загальна напівструктурна формула амінокислот:
NH2—(CH2)n—COOH.
Отже, амінокислоти — це біфункціональні сполуки. Вони містять дві характеристичні групи — карбоксильну й аміногрупу, тому їхні властивості зумовлені цими двома групами.
Вуглеводневий залишок може бути будь-яким: насиченим, ненасиченим, ароматичним тощо.
Найпростіша амінокислота — аміноетанова, її також називають амінооцтова кислота, або гліцин:

Номенклатура амінокислот
Принцип утворення назв амінокислот такий самий, як і для карбонових кислот:

Але існують певні особливості, зумовлені наявністю двох характеристичних груп. Із них карбоксильна група є старшою, тому:
• за родоначальну структуру обирають ланцюг, що містить карбоксильну групу;
• нумерацію атомів головного ланцюга починають з атома Карбону у складі карбоксильної групи;
• наявність аміногрупи позначають у назві префіксом аміно-, тобто її називають, як звичайний замісник.

Атоми Карбону головного ланцюга можна позначати не цифрами, а буквами грецького алфавіту, причому нумерацію слід починати від атома Карбону, найближчого до карбоксильної групи:

У природі переважають α-амінокислоти, тільки ці амінокислоти утворюють білки, тобто є протеїногенними.
Фізичні властивості амінокислот
Амінокислоти — тверді безбарвні кристалічні речовини, добре розчинні у воді й погано — в органічних розчинниках. Розчинність амінокислот у воді пояснюється можливістю утворення водневих зв'язків карбоксильною групою (як у карбонових кислот) та аміногрупою (як у амінів). Деякі амінокислоти солодкі на смак.
Водні розчини більшості амінокислот мають нейтральне середовище.
22.04.20.
ТЕМА: Хімічні властивості аміноетанової кислоти. Пептиди. |
Хімічні властивості амінокислот
Для амінокислот характерні хімічні властивості карбонових кислот і амінів завдяки наявності в їхніх молекулах двох характеристичних груп. Карбоксильна група зумовлює кислотні, а аміногрупа — основні властивості амінокислот. Отже, амінокислоти є органічними амфотерними сполуками.
1. Взаємодія з лугами відбувається за участі карбоксильної групи:
Назва солі утворюється аналогічно назвам солей карбонових кислот. Якщо кислота аміноетанова, то її сіль називають аміноетаноат.
2. Взаємодія з кислотами відбувається за участі аміногрупи:
NH2-CH2-COOH + HCl → [NH+3-CH2-COOH]Cl-
Назва цієї солі утворюється подібно до назв амінів: аміноетанова кислота гідрохлорид.
Іноді амінокислота сама є і кислотою, і основою одночасно, у цьому випадку йон Гідрогену з карбоксильної групи приєднується до аміногрупи:
NH2-CH2-COOH → NH+3-CH2-COO-
Таку сіль називають внутрішньою, вона існує у вигляді біполярних йонів, хоча за складом вона не відрізняється від початкової кислоти. Взагалі кислотно-основні взаємодії амінокислот можна записати такою схемою, що повною мірою відображає амфотерність амінокислот:

3. Утворення поліпептидів. Ди-, три- та поліпептиди утворюються в реакції поліконденсації. За певних умов група -COOH однієї молекули може реагувати з групою -NH2 іншої молекули, при цьому відщеплюється молекула води й утворюється продукт, у якому залишки амінокислот сполучені так званим пептидним зв'язком:

Продукт цієї реакції називають дипептидом, наприклад дипептид аміноетанової кислоти. Як і амінокислоти, він також містить дві різні функціональні групи (-NH2 і -COOH), а отже, може реагувати ще з однією молекулою амінокислоти, утворюючи трипептид:

Процес подовження пептидного ланцюга може відбуватися багаторазово, у результаті чого утворюються речовини з великою молекулярною масою — поліпептиди. Це єдиний процес синтезу білків з амінокислот у рибосомах, у дослідження яких вагомий внесок зробила Ада Йонат.

Ада Йонат (народилася 1939 р.)
Досліджувала будову білкових молекул.
Біологічне значення амінокислот
Амінокислоти — це цеглинки, з яких побудовані білки, а отже, вони є основою життя на нашій планеті. Уперше про амінокислотний склад білків висловив припущення український учений І. Я. Горбачевський.

Іван Якович Горбачевський (1854-1942)
Установив, що білки мають амінокислотну природу.
Амінокислоти добувають гідролізом білків або синтезують із відповідних карбонових кислот. Їх використовують як поживні речовини в медицині та як харчові добавки до продуктів і сільськогосподарських кормів, для приготування коктейлей для спортивного харчування.
Аспартам — речовина, яку рекомендують для вживання людям із цукровим діабетом та з надмірною вагою. Він у 160-200 разів солодший за цукор, при цьому його калорійність незначна. Він не має гіркого металічного присмаку, характерного для сахарину. Аспартам є дипептидом, утвореним аспарагіновою кислотою та фенілаланіном, він добре засвоюється організмом людини. Він не призводить до утворення карієсу зубів, а його засвоєння не залежить від вироблення організмом інсуліну.

Добування амінокислот. Амінокислоти добувають подібно до амінів: із хлоропохідних карбонових кислот нагріванням їх з амоніаком
R-CHCl-COOH + 2NH3 → R-CHNH2-COOH + NH4Cl
24.04.20.
ТЕМА: Білки як високомолекулярні сполуки.
Параграф підручника №25
Білки — природні високомолекулярні сполуки, молекули яких складаються із залишків молекул амінокислот, які сполучені один з одним пептидними зв'язками.
Білки є полімерами, мономерами яких є амінокислоти. Зазвичай білки містять 100 і більше залишків молекул амінокислот. Більшість білків людського організму містять кілька сотень амінокислотних залишків. Отже, молекулярна маса білків коливається від декількох тисяч до декількох мільйонів.
За складом білки поділяють на протеїни — прості білки, що складаються із залишків молекул амінокислот, і протеїди — складні білки, що складаються із залишків молекул амінокислот і різних небілкових речовин, зокрема йонів металічних елементів.
Будова молекул. Білки за своєю будовою не мають аналогів серед інших органічних сполук, з якими ви ознайомилися на уроках хімії. Молекули цих речовин складаються із фрагментів молекул α-амінокислот, сполучених пептидними групами. З курсу біології вам відомо, що існують чотири рівні структурної організації білків.
Первинна структура білка — це поліпептидний ланцюг із чіткою послідовністю амінокислотних залишків:

(R — вуглеводневі та інші залишки).
Ланцюг може набувати певної просторової форми (здебільшого — спіралі) завдяки утворенню водневого зв’язку між атомом Оксигену СО-групи одного витка спіралі й атомом Гідрогену NH-групи сусіднього витка. Таку структуру білка називають вторинною (мал. 80).

Мал. 80. Вторинна структура білка
Третинна структура формується при згортанні спіралі поліпептидного ланцюга у клубок (глобулу) внаслідок виникнення зв'язків -S-S-, -СОО- ...+NH3- між фрагментами молекул.Четвертинна структура білка є системою складної форми; у ній об’єднано кілька глобул. Це — єдиний комплекс, який виконує певну функцію в живому організмі. Між фрагментами глобул виникають нові водневі та інші зв’язки. Таку структуру має гемоглобін; його молекула складається із чотирьох глобул.
Хімічні властивості білків
1. Денатурація білків. Під дією різних чинників білки можуть розкладатися, втрачаючи свою специфічну просторову будову. Руйнування просторової структури білка зі збереженням його первинної структури називають денатурацією. Вона відбувається під час нагрівання, зміни кислотності середовища, дії випромінювання або розчинів солей важких металічних елементів та органічних розчинників. Прикладами денатурації є згортання яєчних білків під час варіння яєць або ущільнення білків молока під час скисання.
2. Гідроліз білків. Інша хімічна властивість білків — здатність до гідролізу в кислому або лужному середовищі. Під час гідролізу розриваються пептидні зв'язки і відбувається розщеплення поліпептидного ланцюга. Повний гідроліз до окремих амінокислот відбувається під час тривалого нагрівання білків з концентрованою хлоридною кислотою.
Кольорові реакції білків. Для виявлення білків або окремих амінокислот у їхньому складі використовують спеціальні якісні реакції, які називають кольоровими реакціями білків.
Так, у разі дії на слаболужний розчин білка розчину купрум(ІІ) сульфату розчин набуває фіолетово-синього забарвлення, що зумовлене зв'язуванням йонів Купруму Cu2+ поліпептидами (мал. 31.1). Цю реакцію називають біуретовою, вона є універсальною для всіх білків, оскільки виявляє наявність пептидних зв'язків.

Мал. 31.1. У пробірці знизу — осад купрум(ІІ) гідроксиду, що не прореагував, у верхній частині сполука Купруму з поліпептидним ланцюгом
За допомогою ксантопротеїнової реакції можна виявити ароматичні амінокислоти у складі білків, наприклад тирозин, триптофан, фенілаланін тощо. Для проведення цієї реакції на білок або його розчин діють концентрованою нітратною кислотою. За наявності залишків ароматичних амінокислот білок забарвлюється у жовтий колір (мал. 31.2, а). Після додавання в реакційну суміш розчину амоніаку колір білка поглиблюється і стає жовтогарячим (мал. 31.2, б).

Мал. 31.2. Колір білка в ксантопротеїновій реакції після додавання нітратної кислоти (а) та після додавання розчину амоніаку (б)
Біологічне значення білків
Білки у живих організмах виконують найрізноманітніші функції, що ви вивчали на уроках біології. Згадаймо найважливіші з них.
Усі без винятку хімічні реакції в організмі відбуваються за наявності спеціальних каталізаторів — ферментів (або ензимів), що являють собою білкові молекули. Вони прискорюють реакції в мільйони разів, причому кожну реакцію каталізує певний фермент.
Деякі білки виконують транспортну функцію — переносять молекули або йони в місця синтезу або накопичення речовин. Наприклад, білок гемоглобін у складі еритроцитів переносить кисень до тканин і вуглекислий газ від них, а білок міоглобін запасає кисень у м'язах.
Білки — це будівельний матеріал клітин, із них побудовані тканини організму.
Білки-рецептори сприймають і передають сигнали, що надходять від сусідніх клітин або з навколишнього середовища. Наприклад, дію світла на сітківку ока сприймає білок родопсин.
Білки життєво необхідні будь-якому організму і тому є найважливішою складовою частиною харчових продуктів. У процесі травлення вони гідролізуються до амінокислот, що є сировиною для синтезу інших білків, необхідних організму.
29.04.20.
ТЕМА: Синтетичні високомолекулярні речовин. Полімери. Пластмаси.
Параграф №28, 29.
Термін «полімерія» був уведений у науку Йенсом Берцеліусом ще в 1833 р. для позначення особливого виду ізомерії, за якої речовини (полімери) з однаковим якісним складом мають різну молекулярну масу, наприклад етен С2Н4 і бутен С4Н8, кисень О2 й озон О3. Полімери в сучасному сенсі не були на той час відомі, але термін зберігся дотепер.

• Макромолекула — молекула з високою відносною молекулярною масою (понад кілька тисяч), що структурно складається з багатократно повторюваних ланок.
• Макромолекул стосуються терміни: мономер, структурна ланка, ступінь полімеризації, відносна молекулярна маса.
• Мономер — речовина з низькою відносною молекулярною масою, її молекули беруть участь в утворенні макромолекули полімеру.
Структурна ланка — група атомів, що багаторазово повторюється у структурі полімеру.
• Ступінь полімеризації (n) — кількість структурних ланок у молекулі полімеру.
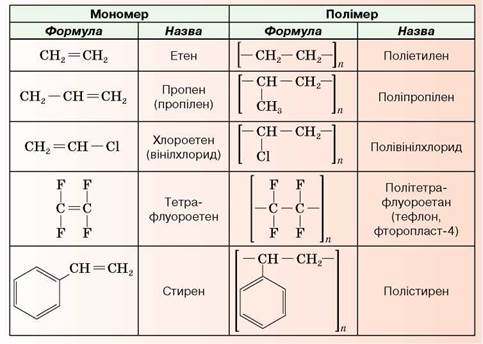
• На прикладі поліетилену структурні елементи полімеру показує запис:

• Відносна молекулярна маса полімеру — величина приблизна (є винятки, наприклад, білки).
РІЗНОМАНІТНІСТЬ ПОЛІМЕРІВ. Дослівно з грецької: poli — це багато, meros — частина.
Вивчаючи етен, крохмаль, целюлозу, ви з'ясували, що полімер — ключове поняття хімії високомолекулярних речовин. Воно стосується всіх сполук, молекули яких складаються із багатьох, хімічно зв'язаних між собою, структурних ланок.
Молекулярна маса полімерів приблизна, вона може становити від кількох тисяч до кількох мільйонів.
Полімери бувають природні й синтетичні.
До відомих вам природних полімерів належать крохмаль, целюлоза, білок та деякі інші. Їх синтез здійснюється у клітинах живих істот. За допомогою різних методів полімери виділяють з рослинної чи тваринної сировини.
Синтетичні полімери (синтетичні високомолекулярні речовини) добувають на заводах, використовуючи відповідні низькомолекулярні реагенти в якості мономерів. Прикладами синтетичних полімерів є поліетилен, поліпропілен, синтетичний каучук.
За походженням полімери поділяються на природні (біополімери) й синтетичні. До природних полімерів належать крохмаль, целюлоза, білки, нуклеїнові кислоти. Синтетичні полімери — це продукція хімічної промисловості (пластмаси, каучуки, синтетичні волокна).
ХІМІЗМ ДОБУВАННЯ ПОЛІМЕРІВ. Полімери утворюються внаслідок реакцій полімеризації чи поліконденсації.
Полімеризація — процес перетворення мономера або суміші мономерів на полімер шляхом послідовного приєднання молекул мономерів до ланцюга, що збільшується, з утворенням високомолекулярної сполуки.
Тобто під час полімеризації всі атоми, що входили до складу молекул мономера (мономерів), переходять у склад макромолекули полімеру. Утворення поліетилену — приклад реакції полімеризації.
Поліконденсація — це процес утворення високомолекулярних сполук за рахунок взаємодії функціональних груп молекул мономера (мономерів), внаслідок чого утворюються полімер і низькомолекулярна речовина, наприклад, вода.
Тобто під час поліконденсації не всі атоми, що входять до складу молекул мономера (мономерів), переходять у склад полімеру. Частина з них утворює ще одну речовину — низькомолекулярний продукт реакції. Утворення крохмалю й целюлози — приклади реакцій поліконденсації: із молекул глюкози утворюється крохмаль чи целюлоза й вода.
Пригадайте схему утворення цих полісахаридів.
ФОРМА МАКРОМОЛЕКУЛ ПОЛІМЕРІВ. Вона буває: лінійною, розгалуженою, сітчастою. Про сітчасту дізнаєтесь, вивчаючи каучуки.
Лінійними називають полімери, які складаються з макромолекул, що не мають розгалужень або мають дуже малі розгалуження. З ними ви вже ознайомились, вивчаючи поліетилен і целюлозу. Полімери лінійної будови здатні утворювати високоміцні волокна і плівки.
Розгалуженими називають полімери, макромолекули яких мають великі розгалуження, наприклад крохмаль (в амілопектині). До сітчастих відносять полімери, у яких між макромолекулами існують хімічні зв'язки. Їх можуть забезпечувати атоми іншої речовини, як це відбувається в гуми.
ЯК РЕАГУЮТЬ ПОЛІМЕРИ НА ПІДВИЩЕННЯ ТЕМПЕРАТУРИ. На полімери по-різному впливає підвищення температури. За цією характеристикою їх поділяють на термопластичні (термопласти) та термореакційні (реактопласти).
Властивість тіл змінювати форму в нагрітому стані і зберігати її після охолодження називають термопластичністю.
Термопластичні полімери або термопласти можна багаторазово розм'якшувати нагріванням і виготовляти з них вироби іншої форми. Після охолодження набута форма зберігається. До термопластів (термопластичних пластмас) належать поліетилен, поліпропілен, полівінілхлорид, полістирен та інші.
На відміну від термопластичних, термореактивні полімери за нагрівання не розм'якшуються і не плавляться. Під впливом температури відбувається необоротне руйнування їх молекул. Прикладом реактопластів (термореактивних пластмас) є фенолформальдегідні смоли.
Поміркуйте, до фізичних чи хімічних явищ належить виготовлення виробів із пластмас.
СИРОВИННА БАЗА ВИРОБНИЦТВА СИНТЕТИЧНИХ ВИСОКОМОЛЕКУЛЯРНИХ РЕЧОВИН. Сучасне виробництво цієї групи полімерів здійснюється з використанням продуктів переробки нафти, попутного й природного газу. Частка вуглеводневої сировини в їх виробництві найбільша. Сировиною слугують також продукти переробки вугілля, рослини чи окремі їх частини.
Узагальнимо інформацію про полімери у такій схемі:

Сторінка ерудита
Елементоорганічні полімери. Ці сполуки в головному ланцюзі містять атоми, що не належать до елементів-органогенів, — це Силіцій, Титан, Алюміній та інші. Їх ланцюги містять вуглеводневі замісники.
Прикладом елементоорганічних полімерів є представник силіційорганічних полімерів — силікон. Головний ланцюг макромолекули цього полімеру складається з атомів Силіцію й Оксигену, в якому до атомів Силіцію приєднані вуглеводневі замісники: етил, метил, феніл.
Тобто атоми Карбону теж присутні, але вони входять до складу бічних ланцюгів полімеру. У наведеному фрагменті силіційорганічної речовини силікону вуглеводневі замісники позначені літерою R:

Через широке застосування в техніці, електроніці, пластичній хірургії, харчовій промисловості й багатьох інших галузях силікон називають матеріалом ХХІ століття.
Існують полімери й серед неорганічних речовин. Прикладами природних неорганічних полімерів є пластична сірка, чорний і червоний фосфор, силіцій(IV) оксид, силікати, поліфосфати, азбест (його ще називають гірський льон).
Матеріали — речовини чи їх суміші, з яких будують дороги, будинки, мости, виготовляють різні предмети (машини, посуд, меблі, одяг) тощо.
Матеріали людина використовувала здавна. Спершу вони були природного походження (шкіра, деревина, камінь, глина). Завдяки розвитку хімії та хімічної промисловості нині створено багато сучасних синтетичних матеріалів, які мають важливі для людини властивості, але не існують у природі. Нині зростання їхнього виробництва набагато випереджає зростання виробництва металів. Важливими представниками полімерних матеріалів є пластмаси, каучуки, волокна.
ПОНЯТТЯ ПРО ПЛАСТМАСИ. За масштабами виробництва серед полімерних матеріалів пластмаси посідають перше місце.
Пластмаси — матеріали на основі полімерів, які здатні за нагрівання набувати заданої форми та зберігати її після охолодження.
Основою пластмас є високомолекулярна сполука — полімер. Крім нього, до складу пластмас входять стабілізатори (антиоксиданти, світлостабілізатори), які сприяють зберіганню властивостей пластмас у процесі їх переробки й використання; пластифікатори, що підвищують еластичність і знижують крихкість пластмас; барвники, які надають матеріалу забарвлення; наповнювачі (деревне та кварцове борошно, тканина, скловолокно, азбест, папір, мелена слюда тощо). Наповнювачі поліпшують механічні властивості матеріалу й роблять його промислове виробництво дешевшим. Зокрема, використовуючи скловолокно, одержують матеріали, що за механічною міцністю не поступаються сталі. Наповнення повітрям або азотом робить пластмаси легким теплоізоляційним матеріалом.
Молекули полімерів можуть мати лінійну, розгалужену й сітчасту (зшиту у площині чи просторі) будову. Це позначається на властивостях пластмас, зокрема на термопластичності й термореактивності.
НАЙПОШИРЕНІШІ ПЛАСТМАСИ.
це тверда, напівпрозора, термопластична, дещо жирна на дотик (нагадує парафін) речовина. Поліетилен горить ледь блакитним тьмяним полум'ям, без запаху, він легший за воду, не розчиняється в ній, нетоксичний. Як матеріал може бути будь-якого кольору за рахунок доданих барвників (мал. 44).

Мал. 44. Поліетилен і вироби з нього
З-поміж відомих полімерів поліетилен має найпростішу будову. Його добувають полімеризацією етену, створюючи відповідні умови (тиск, температура, каталізатор):

Як бачимо з рівняння реакції, утворення макромолекули поліетилену відбулося за рахунок розриву подвійних зв'язків у молекулах мономера етену. Тому в макромолекулі полімеру присутні лише одинарні зв'язки, і за хімічною будовою поліетилен належить до насичених сполук.
Вам відомо, що насичені вуглеводні від ненасичених можна відрізнити за допомогою якісних реакцій. Так, ненасичені вуглеводні за звичайних умов вступають у реакції приєднання та окиснення, насичені — ні. Поліетилен не приєднує бром і не змінює забарвлення його водного розчину, не окиснюється розчином калій перманганату, тому забарвлення розчину залишається незмінними. Це доводить насичений характер поліетилену.
Попрацюйте з малюнком 45, на якому зображено кулестрижневу модель фрагмента полімерного ланцюга поліетилену, і переконайтесь, що подвійні зв'язки відсутні, усі зв'язки одинарні, що характерно для насичених сполук.

Мал. 45. Кулестрижнева модель фрагмента макромолекули поліетилену
Щоб з'ясувати, до термопластичних чи термореактивних пластмас належить поліетилен, можна виконати такий дослід. Шматок зразка поліетилену помістити на предметне скло й нагрівати. Через деякий час спробувати скляною паличкою змінити форму зразка — і це легко вдасться. Після охолодження набута форма залишиться. Робимо висновок, що поліетилен належить до термопластичних пластмас.
Поліетилен горить. Щоб дослідити горіння поліетилену, закріпимо шматок поліетиленового зразка та підпалимо його (мал. 46). Спостерігатимемо, як поліетилен швидко спалахує і горить світним полум'ям без кіптяви.

Мал. 46. Згорання поліетиленового виробу
Поліетилен, як і всі насичені сполуки, стійкий до дії кислот і лугів, тому з нього виготовляють ємкості для зберігання і транспортування цих речовин. Однак гаряча концентрована нітратна кислота руйнує його.
Поліетилен, на відміну від свого мономера етену, — стійка до дії кислот, лугів, окисників високомолекулярна речовина, що належить до пластмас.
Стійкість поліетилену за кімнатної температури до дії органічних розчинників забезпечує йому широке використання у виготовленні посуду, труб. Майже половина всього поліетилену використовується у виробництві поліетиленової плівки та як пакувальний матеріал. Завдяки нетоксичності поліетилен використовують як матеріал для виготовлення водопровідних труб, зручних виробів домашнього вжитку. Високі діелектричні показники поліетилену дають змогу використовувати його для ізоляції дротів.
Широке застосування поліетилену забезпечують його властивості: легкість, простота переробки, висока хімічна стійкість, термопластичність, відсутність електропровідності.
Найпоширеніші пластмаси:

06.05.20.
ТЕМА: Захист навчальних проектів.
Обрати одну з тем:
1) Рециклінг як єдиний
цивілізований спосіб утилізації твердих побутових відходів.
2) Переробка побутових
відходів в Україні та розвинених країнах світу.
3) Перспективи одержання
і застосування полімерів із наперед заданими властивостями.
4) Дослідження маркування
виробів із полімерних матеріалів і пластмас.
5) Виготовлення виробів
із пластикових пляшок.
08.05.20.
ТЕМА:Каучуки, гума. Синтетичні волокна.
Параграф №30, 31
Серед полімерів окремо виділяють групу речовин, які називають еластомерами, або каучуками.
• Еластомери (каучуки) — це природні або синтетичні високомолекулярні сполуки, що відрізняються від інших полімерів високою еластичністю, водонепроникністю.
Молекули каучуків зазвичай скручені в клубки. Під час розтягування молекули витягуються, а після зняття зовнішнього навантаження — скручуються. Цим пояснюється еластичність каучуків.
Натуральний каучук був уперше описаний французьким астрономом та мандрівником Шарлем Марі де ла Кондоміном 1751 року. У мандрівці Південною Америкою він побачив як індіанці збирають молочний сік з дерев (гевея бразильська) і на вогнищі перетворюють його на еластичний матеріал — натуральний каучук.

Збирання молочного соку (латексу) з гевеї
Молочний сік бразильської гевеї та інших каучуконосних рослин (кок-сагизу, крим-сагизу або кульбаби осінньої тощо), який ще називають латексом, містить у складі полімер ізопрену. Під час нагрівання або іншої обробки цей полімер вивільнюється й утворює натуральний каучук.
Натуральний (природний) каучук — це високомолекулярна ненасичена сполука з відносною молекулярною масою 15 000-500 000, мономером якої є дієновий вуглеводень 2-метилбута-1,3-дієн С5Н8. Тривіальна назва цієї сполуки — ізопрен.

Сергій Васильович Лебедєв (1874-1934)
Розробив дешевий спосіб виробництва каучуку.
Із розвитком автомобільної промисловості потреба в каучуку, з якого виготовляли шини, стрімко зростала. Виробництво натурального каучуку не могло задовольнити всі потреби, і постало завдання добути каучук синтетичний. Уперше синтетичний бутадієновий каучук полімеризацією бутадієну добув 1910 року С. В. Лебедєв, який згодом став одним із засновників промислового синтезу каучуків. Синтетичний каучук став промислово вигідним після винайдення способу добувати бутадієн з етанолу пропусканням спирту над каталізатором (реакція Лебедєва) записати:

Синтез каучуків ще значно здешевів після винайдення каталізаторів Циглера — Натти.
Більша частина натурального та синтетичного каучуків витрачається на виробництво автомобільних, авіаційних та велосипедних шин. Латекс і натуральний каучук використовують у виробництві медичних засобів (еластичний бинт, хірургічні рукавички, катетери тощо), а також гумок для стирання, повітряних кульок, деяких видів взуття, презервативів, сосок (пустушок) тощо.
Залежно від будови макромолекул, умов проведення полімеризації та мономерів розрізняють декілька видів каучуків.
Найважливіші види каучуків
Назва
|
Мономер
|
Особливі властивості, застосування
|
Бутадієновий
|
Бута-1,3-дієн*
|
Водо- та газонепроникний, відносно низька пластичність, міцність, морозостійкість. Виготовляють ізоляційні покриття, взуття, побутові гумові вироби
|
Дивініловий
|
Бута-1,3-дієн*
|
За еластичністю подібний до натурального каучуку, за зносостійкістю перевершує його, але поступається за електроізоляційними властивостями. Застосовують переважно у виробництві шин
|
Ізопреновий
|
Ізопрен (2-метилбута-1,3-дієн)
|
За властивостями подібний до натурального каучуку. Виготовляють шини, шланги, ізоляцію для електричних кабелів тощо
|
Хлоропреновий
|
Хлоропрен (2-хлоробута-1,3-дієн)
|
Стійкий до дії високих і низьких температур, бензинів та мастил. Виробництво кабелів, шлангів, трубопроводів для транспортування бензину й нафти
|
* Хоча мономер однаковий, але каучуки відрізняються просторовою будовою.
Матеріали на основі каучуків. Вулканізація. Гума
Натуральний каучук та його синтетичні аналоги мають певні недоліки. Вироби з них недостатньо міцні, їхня еластичність проявляється у невеликому інтервалі температур: за низької температури взимку вони стають надто твердими та розтріскуються, а за високої температури влітку — розм'якшуються та перетворюються на липку масу.
Для усунення недоліків каучуки піддають процесу вулканізації. Вулканізація — технологічний процес хімічної взаємодії каучуків з певним вулканізуючим агентом, частіше сіркою, а також пероксидами та оксидами металічних елементів тощо. Під час вулканізації відбувається «зшивання» молекул каучуку в єдину просторову тривимірну сітку, завдяки чому каучук стає міцнішим та еластичнішим, зменшується його розчинність (мал. 34.2).

Мал. 34.2. Під час вулканізації сіркою макромолекули каучуку «зшиваються» у тривимірну сітку
Під час вулканізації до каучуків додають також наповнювачі, стабілізатори, пластифікатори тощо. Автомобільні шини мають чорний колір саме внаслідок додавання до каучуку сажі. У такий спосіб досягають світлостабільності отриманого матеріалу: сонячне світло поглинається сажею, а не каучуком, молекули якого руйнуються під дією сильного освітлення.
Вулканізацією каучуку добувають різні види гуми:
• м'яку гуму (містить 1-3 % сірки);
• напівтверду гуму (містить 10-15 % сірки);
• тверду гуму, або ебоніт (містить 30-50 % сірки).
М'яка та напівтверда гуми — еластичні матеріали. На відміну від них ебоніт (від грец. ebenos — чорне дерево) не виявляє еластичності. Він досить твердий і піддається механічній обробці. Сьогодні ебоніт зазвичай використовують лише як замінник дорогих матеріалів (чорного дерева, рогу тощо) для виготовлення перових ручок, гребінців, рукояток ножів, мундштуків духових музичних інструментів, прикрас тощо (мал. 34.3).

Мал. 34.3. Вироби з ебоніту
Процес вулканізації також використовують для ремонту автомобільних шин. Сирий каучук дуже еластичний та липне до предметів. Латочку з нього накладають на прокол у камері та піддають вулканізації, після чого пробоїна затягується і зникає (мал. 34.4).

Мал. 34.4. Накладання латочки з каучуку на пробоїну автомобільної камери для вулканізації
Процес вулканізації 1839 року винайшов та запатентував американський винахідник Чарльз Гуд'їр і назвав його на честь давньоримського бога вогню — Вулкана.
Волокнами називають матеріали, що складаються з довгих і тонких ниток або відрізків ниток, придатних для виготовлення пряжі й тканин. За походженням волокна поділяють на натуральні й хімічні.
ХІМІЧНІ ВОЛОКНА. Класифікацію хімічних волокон здійснюють за походженням сировини, з якої їх виробляють.
Запишіть схему:
Якщо сировиною для виробництва хімічного волокна є природний полімер, волокно називають штучним. Якщо ж сировиною є продукти органічного синтезу, то й хімічне волокно називають синтетичним.
Ознайомтеся з класифікацією волокон і прикладами, скориставшись малюнком.

СИНТЕТИЧНІ ВОЛОКНА. Це теж хімічні волокна, але для їхнього виробництва не використовується натуральна (природна) сировина. З продуктів переробки нафти, кам'яного вугілля, природного газу спершу добувають полімер, який далі перетворюють на волокно, а термостійкі полімери просто розплавляють.
Синтетичні волокна виробляють з органічних сполук, здійснюючи хімічні реакції. До цих волокон належать поліпропіленове, полівінілхлоридне, поліестерні та ін. Вони переважають природні волокна за міцністю, еластичністю, довговічністю, не руйнуються мікроорганізмами. Недоліки синтетичних волокон — низька гігроскопічність, здатність до електризації. З метою їх подолання до синтетичних волокон додають природні, а також речовини-антистатики.
Лавсан — поліестерне волокно. Воно нагадує вовну, але є міцнішим. Вироби із цього волокна не потребують прасування.

Тканини з лавсану
Лавсан — термостійкий, погано загоряється й не обвуглюється, не розчиняється в органічних розчинниках, але руйнується кислотами і лугами. Нитки із цього волокна мають низьку гігроскопічність. Тому при виготовленні тканин їх часто змішують з бавовняними, лляними або вовняними нитками.

Нитки і краватки з поліестеру
Поліестерне волокно використовують для виготовлення бензино- й нафтостійких шлангів, канатів, риболовних тралів, електроізоляційних матеріалів, вітрил, декоративних тканин, штучного хутра, ковдр, а також у виробництві шин.
Капрон і найлон — поліамідні волокна. Вони міцні, витримують низькі температури, є хімічно стійкими (руйнуються лише концентрованими неорганічними кислотами), легко забарвлюються. Капронові нитки використовують для виготовлення канатів, риболовних сіток, різних тканин. Найлонове волокно додають до інших волокон; його застосовують у виробництві ковроліну, спортивного одягу.

Нитки і тканина з капрону
Сторінка ерудита
Кевлар (поліпарафенілентерефталамід) — синтетичне волокно високої механічної й термічної міцності, склад якого передає наведена формула.
Його розробником є американська хімік і винахідник Стефані Кволек (1923-2014).
Це легкий і міцний (в 5 разів міцніше сталі), нешкідливий для здоров'я людини, стійкий до перепадів температур матеріал. З нього виготовляють куленепробивні бронежилети і шоломи — засоби індивідуального захисту військовослужбовців і поліцейських, негорючий одяг пожежників. Кевларова тканина також стійка до дії органічних розчинників. Під впливом низьких температур міцність кевларової тканини зростає, проте сонячні промені й волога роблять волокно менш міцним, тому його покривають спеціальним захисним шаром.

13.05.20.
ТЕМА: Зв'язки між класами органічних речовин. Загальні відомості про біологічно активні речовини (вітаміни, ферменти).
Параграф №32,33.
ЗВ'ЯЗКИ МІЖ КЛАСАМИ ОРГАНІЧНИХ РЕЧОВИН. Як ви пам'ятаєте, вивчення органічних сполук відбувалося в послідовності від найпростіших (вуглеводнів) до найскладніших (високомолекулярних сполук), акцентувалась увага на поширенні в природі й добуванні речовин. Ви мали змогу неодноразово переконатися, що з одних органічних сполук утворюються інші. Це свідчить про наявність зв'язків між класами органічних речовин. Їх відображає схема на малюнку 57.

Мал. 57. Схема взаємозв'язків між органічними сполуками


Біологічно активні речовини
Наш організм потребує не лише білків, жирів, вуглеводів. Існують інші органічні речовини, які необхідні організму; їх називають біологічно активними.
Біологічно активні речовини — це речовини, які активно впливають на різноманітні процеси в живих організмах.
До найважливіших речовин цього типу зараховують вітаміни, ферменти, антибіотики, алкалоїди, гормони. Ці сполуки спочатку було виявлено в природі (передусім у рослинах). Згодом більшість таких речовин учені почали добувати в лабораторіях.
Біологічно активні речовини різняться за складом і будовою молекул. Серед них багато нітрогеновмісних сполук. Їхні молекули містять цикли, до яких, крім атомів Карбону, входять атоми Нітрогену, Оксигену.
Біологічно активні речовини є в складі численних лікарських засобів.
Якщо до цього ми об'єднували органічні речовини в групи чи класи, враховуючи спільне в їх будові та властивостях, то виокремлення групи вітамінів відбулося по-іншому. У них різна будова, не схожі хімічні властивості, але спільне значення (біологічна роль) у живій природі.
Вітаміни — низькомолекулярні органічні сполуки різних класів з відносною молекулярною масою (від кількох десятків до кількох сотень), які в невеликих кількостях, але обов'язково потрібні для здійснення хімічних процесів в організмах.
Ще століття тому про вітаміни й гадки не мали, однак наслідки їх нестачі, що призводили до тяжких захворювань на рахіт, курячу сліпоту, цингу та деякі інші захворювання, були відомі.
Дослідження складу й властивостей вітамінів бере початок із праць Миколи Івановича Луніна. Учений експериментально довів, що для нормального функціонування організмів тварин і людини, крім білків, жирів і вуглеводів, необхідні інші, невідомі на той час, компоненти їжі. Після відкриття їх назвали вітамінами (vita — життя). Вчені виділили вітаміни в чистому вигляді, дослідили їхні будову й властивості, завдяки чому став можливим синтез вітамінів за межами організму, тобто їхнє промислове виробництво.
До групи вітамінів належить понад 20 органічних речовин природного походження й чимало їхніх синтезованих аналогів.
Вітаміни, окрім назви, мають умовні позначення великими літерами латинського алфавіту, а деякі з них ще й числами. З позначеннями, назвами вітамінів та середньою добовою потребою дорослої людини в них ознайомтеся за таблицею 15.
Таблиця 15
Вітаміни
|
Середня добова норма
| |
Позначення
|
Назва
| |
С
|
Аскорбінова кислота
|
100-200 мг (лікувальна доза до 2 г)
|
В1
|
Тіамін
|
1,1-1,5 мг
|
В2
|
Рибофлавін
|
1-3 мг
|
В6
|
Піридоксин
|
2-2,2 мг
|
В12
|
Ціанокобаламін
|
3 мкг
|
РР
|
Ніацин, нікотинова кислота
|
20-25 мг
|
Закінчення таблиці 15
Позначення
|
Назва
|
Середня добова норма
|
Н
|
Біотин
|
150-200 мкг
|
К
|
Нафтохінони
|
0,5 мг
|
А
|
Ретинол
|
1 мг
|
D
|
Кальциферол
|
10-25 мкг
|
E
|
Токоферол
|
10 мг
|
Наведені нижче для ознайомлення (не для запам'ятовування) формули свідчать, наскільки різноманітні склад і хімічна будова вітамінів.

Здебільшого у складі вітамінів наявні атоми Карбону, Гідрогену, Оксигену, Нітрогену. Проте існують вітаміни, якісний склад яких доповнений атомами інших хімічних елементів.
За здатністю розчинятися у воді вітаміни поділяють на водорозчинні (наприклад, С, РР, В1, В2) та жиророзчинні (наприклад, А, Е, K). Водорозчинні вітаміни не накопичуються в організмі людини, тому мають надходити до нього постійно. Для засвоєння жиророзчинних вітамінів у їжі мають бути жири.
БІОЛОГІЧНА РОЛЬ ВІТАМІНІВ. Вітаміни регулюють в організмі обмін речовин через систему ферментів, діють у комплексі з ними. І нестача навіть одного вітаміну є небезпечною, бо порушуються обмінні процеси, унаслідок чого розвиваються різного роду захворювання. Потреба у вітамінах кожної людини індивідуальна й залежить від віку, стану здоров'я й навіть пори року. Найбільше організм людини потерпає від нестачі двох вітамінів — С і В1.
У тому, що вітаміни потрібні в дуже малій кількості, переконує таке порівняння: маса добової норми вітамінів для дорослої людини буде меншою від маси однієї насінини проса.
Організм людини досить чутливий до вмісту в ньому кожного з вітамінів і йому однаково небезпечні як нестача, так і надлишок вітамінів. За нестачі розвивається захворювання на гіповітаміноз, за надлишку — на гіпервітаміноз. Стан, коли вітамін в організмі відсутній, називають авітаміноз. Організм людини так влаштований, що не синтезує більшості вітамінів, а тому надходження їх з їжею обов'язкове. З метою профілактики авітамінозу можна вдатися до вживання вітамінних препаратів — полівітамінів, одна пігулка яких досить часто містить не лише комплекс вітамінів, а й важливі неорганічні компоненти — мікроелементи.
Під час приготування й споживання страв потрібно пам'ятати, що недотримання правил зберігання продуктів харчування, порушення технології їх кулінарної обробки зменшують вміст біологічно активних речовин, особливо вітамінів.
Вітаміни — необхідний компонент складного процесу обміну речовин. Їх нестача позначається на самопочутті людини, працездатності, стійкості до різних захворювань.
З біологічною роллю окремих вітамінів ви ознайомилися в курсі біології. Ознайомтеся з джерелами надходження вітамінів до організму людини за малюнком 58.

Мал. 58. Джерела надходження вітамінів до організму людини
Вітамін С (аскорбінова кислота). Підвищує захисні сили організму, поліпшує еластичність судин, робить організм стійким до захворювань дихальних шляхів. Стимулює діяльність ендокринної й центральної нервової систем, сприяє кращому засвоєнню йонів Феруму й нормальному кровотворенню.
Нестача вітаміну C проявляється втомою, кровоточивістю ясен, зниженням опірності організму до інфекцій. У випадку авітамінозу розвивається захворювання на цингу. Джерелами вітаміну C є шипшина, кизил, чорна смородина, плоди цитрусових, червоний перець, хрін, петрушка, зелена цибуля, кріп, картопля, капуста, лісові ягоди тощо.
Вітамін А (ретинол) — вітамін росту й зору. Впливає на ріст людини, поліпшує стан шкіри, посилює опірність організму до інфекцій. У разі нестачі вітаміну погіршується зір, що може призвести до захворювання на курячу сліпоту, розвивається сухість шкіри, організм втрачає вагу. На відміну від вітаміну C, якого найбільше в рослинній їжі, на вітамін А багаті продукти тваринного походження — риб'ячий жир, молочні жири, вершкове масло, сир, яйця, печінка тощо. У рослинах міститься каротин, який в організмі людини у присутності жирів перетворюється на вітамін А.
Речовини їжі, що в організмі людини перетворюються на вітаміни, дістали назву провітаміни.
На каротин багаті морква, червоний перець, абрикоси, гарбузи та інші.
Вітаміни групи В відповідальні за енергетичний обмін в організмі, поліпшують пам'ять, зменшують болі при радикулітах, невритах, захворюваннях органів травлення.
Вітамін В1 (тіамін) позитивно впливає на м'язи й нервову систему, утворює комплекси з ферментами, що регулюють обмін вуглеводів та амінокислот. Міститься переважно в рослинах (зернівках гречки, проса, вівса), волоських горіхах, абрикосах, шипшині, капусті. Багатий вітаміном В1 пшеничний хліб грубого помолу. Тіамін є також у молоці, м'ясі, яєчному жовтку, дріжджах.
Вітамін В2 (рибофлавін) впливає на ріст і відновлення клітин, бере участь у процесах окиснення в усіх тканинах тіла людини, підтримує нормальне функціонування очей. Природними джерелами вітаміну В2 є печінка, молоко, яйця, дріжджі, а також зернобобові рослини, шипшина, абрикоси, капуста, помідори.
Вітамін В9, або фолієва кислота, бере участь у процесах кровотворення, а також у синтезі нуклеїнових кислот. Найбільше його в зелені та овочах — петрушці, квасолі, шпинаті, салаті, а також у печінці, нирках, хлібі, сирі.
Вітамін D (кальциферол) регулює фосфорно-кальцієвий обмін в організмі. Він забезпечує всмоктування йонів Кальцію в кишечнику і транспортування їх до кісткової тканини. У разі нестачі цього вітаміну порушується сольовий обмін, у кістках недостатньо відкладається сполук Кальцію, вони втрачають міцність, а в дітей з'являється захворювання на рахіт. Найліпшими джерелами вітаміну D є риба й морепродукти.
Вітамін Е (токоферол) сприяє засвоєнню білків і жирів, бере участь у процесах тканинного дихання, впливає на роботу мозку, нервової системи, м'язів, затримує старіння, прискорює загоєння ран. Особливо важливим він є під час великих фізичних навантажень. Найбільше його в нерафінованій олії, особливо в соняшниковій, пророслій пшениці й житі, помідорах, петрушці, насінинах шипшини. У невеликій кількості вітамін Е присутній у жирному м'ясі, молоці, печінці.
Вітамін РР (ніацин, або нікотинова кислота). Задіяний у клітинному диханні й обміні білків, регулює вищу нервову діяльність, роботу органів травлення. Джерелами цього вітаміну є м'ясні продукти, особливо печінка й нирки, яйця, молоко, вироби з борошна грубого помелу, крупи (особливо гречана). Вміст в овочах цього вітаміну незначний.
Ферменти — група речовин переважно білкової природи, які виконують роль каталізаторів біохімічних реакцій в організмах. Ці речовини також називають ензимами. Ензимологія — наука про ферменти, одна з галузей біохімії.
Функцію ферменту можна спрощено пояснити так: спочатку молекули органічної речовини сполучаються з ним, потім продукт цієї реакції взаємодіє з іншою речовиною, а фермент «вивільнюється».
Відомо понад дві тисячі ферментів. Вони утворюються в рослинах, організмах тварин і людини. Одні ферменти прискорюють синтез білків з амінокислот, інші (протеази1) забезпечують протилежний процес — розщеплення білків на амінокислоти. Ліпази є каталізаторами гідролізу жирів — перетворення їх на гліцерол і жирні кислоти. Амілаза сприяє розщепленню молекул крохмалю на молекули простих вуглеводів (моносахаридів). За нестачі ферментів в організмі лікарі рекомендують вживати ферментні препарати.
1 Назви багатьох ферментів мають закінчення -аза.
Ферменти беруть участь у процесах бродіння, які становлять основу виробництва вина, пива, оцту, кисломолочних продуктів, квашення овочів (мал. 111). Дріжджі завдяки наявності в них ферментів використовують при виготовленні хліба (мал. 111), різних виробів із борошна.

Мал. 111. Результати «роботи» ферментів
На властивості ферментів впливають зовнішні умови. За незначного підвищення температури ферменти починають руйнуватися і втрачають каталітичну активність.
Ферменти добувають із тваринної та рослинної сировини, мікроорганізмів, біологічних рідин (наприклад, крові).
20.05.20.
ТЕМА: Контрольна робота з теми "Нітрогеновмісні органічні речовини. Синтетичні ВМС"
22.05.20.
ТЕМА: Представлення результатів навчальних проектів.
1) Доцільність та шкідливість біологічно активних добавок.
2) Найважливіші хімічні виробництва органічної хімії в Україні.
Підготувати презентацію на одну з обраних тем, надіслати за адресою narina0596@gmail.com.
27.05.20.








Комментариев нет:
Отправить комментарий