У робочих зошитах записуємо дату, тему уроку.
Все, що виділено червоним кольором необхідно записати. Малюнки та таблиці за необхідності записати (це буде вказано). НОВІ КОНСПЕКТИ УРОКІВ РОЗМІЩЕНІ НИЖЧЕ
З 24.05.20. результати проектів, практичних робіт, тести, розв'язок задач НЕ ПРИЙМАЮТЬСЯ.
30.03.20
З 24.05.20. результати проектів, практичних робіт, тести, розв'язок задач НЕ ПРИЙМАЮТЬСЯ.
30.03.20
ТЕМА: Хімічні властивості оснόвних, кислотних та амфотерних оксидів: взаємодія з водою, кислотами, лугами, іншими оксидами.
Параграф підручника №30 (записати загальні схеми взаємодії оксидів з речовинами), виконати завдання після параграфу (для засвоєння матеріалу) №2,3,10,11.
Запишіть загальну схему:
Запишіть таблицю :
16.03.2020, 18.03.2020
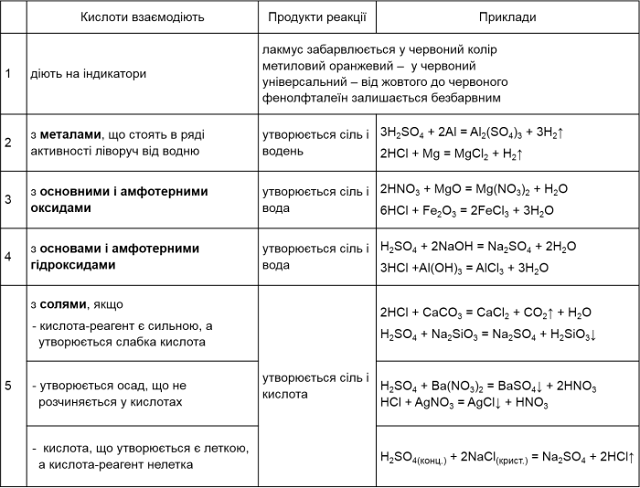
ТЕМА: Хімічні властивості кислот: дія на індикатори, взаємодія з металами, основними оксидами, основами, солями. Реакція нейтралізації. Ряд активності металів. Реакції заміщення й обміну. Заходи безпеки під час роботи з кислотами.
Праграф підручника № 35 Виконати завдання після параграфу № 1,2,5, 6
Записати:
Кислотами називають складні речовини, що складаються з атомів
Гідрогену, які можуть заміщуватися металами, і кислотних залишків.
Кислотним залишком називають
частину молекули кислоти, сполучену з атомами Гідрогену.
При утворенні солей, коли
атоми Гідрогену заміщуються йонами металів, кислотні залишки переходять у
незмінному вигляді. Якщо кислотний залишок у кислоті сполучений з одним атомом
Гідрогену, то він одновалентний, якщо з двома — двовалентний, якщо з
трьома — трьохвалентний, тощо.
Валентність кислотного
залишку визначається кількістю атомів Гідрогену, здатних заміщуватися металами.
Формули і назви деяких
кислот наведено в таблиці.
Записати та вивчити формули кислот та їх назви за номенклатурою.
Кислоти прийнято класифікувати за кількома
ознаками.
1. Існують безоксигенові і оксигеновмісні кислоти.
Назва цих груп вказує на наявність або відсутність в молекулі кислоти атомів
Оксигену.
2. Інша ознака, за
якою групують кислоти — кількість атомів Гідрогену в молекулі кислоти, здатних
заміщуватися металами. Відповідну характеристику кислоти називають її основністю.
Існують одно-, дво- і триосновні кислоти.
Запишіть:
Правила техніки
безпеки при роботі з кислотами.
- Уважно читайте етикетки на склянках
- Речовини для дослідів беріть не більше 1 - 2 мл (наливайте обов'язково над лотком!)
- Не залишайте склянки з кислотами відкритими
- Не виливайте залишки реактивів з пробірки назад у склянку, з якої він був узятий
- Якщо випадково кислота потрапила на руки чи на одяг - негайно змийте її великою кількістю води, нейтралізуйте розчином соди і знову змийте водою
- Нагріваючи кислоти, користуйся тримачем, стежте, щоб стінки пробірки над рідиною не перегрілися, а рівномірно прогрівалася вся пробірка.
- Якщо потрібно розбавити сульфатну кислоту, пам'ятайте правило:
„Спочатку вода,
Потім кислота.
Інакше - трапиться
біда!”
8. Категорично забороняється проводити досліди, не зазначенні в роботі, та самостійно зливати та змішувати реактиви.
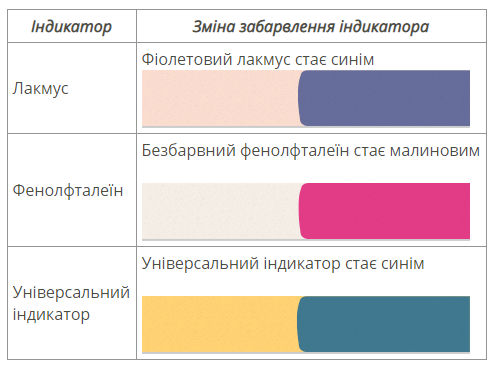
1. Робота із таблицею «Зміна забарвлення індикаторів у
середовищах». Записати:
Завдання: дати відповідь на запитання та запишіть відповідь.
Індикатори це - ?
2. Взаємодія кислот з металами
Кислоти взаємодіють з металами, що стоять в ряду
активності металів лівіше водню. В результаті реакції утворюється сіль і
виділяється водень.
Майже всі метали окиснюються кислотами. Характер
взаємодії з кислотою залежить від активності металу, від його властивостей, а
також від концентрації кислоти.
Як розбавлена так і концентрована хлоридна кислота взаємодіє з металами, які стоять у ряді активності до водню, при цьому виділяється водень та утворюється сіль відповідного металу
Як розбавлена так і концентрована хлоридна кислота взаємодіє з металами, які стоять у ряді активності до водню, при цьому виділяється водень та утворюється сіль відповідного металу
Mg + HCl = MgCl2 + H2
Робота із таблицею «Ряд
активності металів». Записати загальну схему
Можна сказати, що метали, розташовані в ряду активності лівіше, витісняють атоми Гідрогену з кислот.
3. Взаємодія кислот з
основними і амфотерними оксидами
Кислоти реагують з
основними і амфотерними оксидами. У результаті реакції утворюється
сіль і вода.
Наприклад, при взаємодії
основного калій оксиду з нітратною кислотою утворюється сіль калій нітрат, а
при взаємодії амфотерного алюміній оксиду з хлоридною кислотою утворюється сіль
алюміній хлорид:
K2O+2HNO3=2KNO3+H2O;
Al2O3+6HCl=2AlCl3+3H2O.
4. Взаємодія кислот з основами і з амфотерними гідроксидами
Кислоти реагують з основами і з амфотерними гідроксидами, утворюючи сіль і воду.
Так само, як і в попередньому прикладі, при взаємодії калій гідроксиду і алюміній гідроксиду з кислотами утворюються відповідні солі:
KOH+HNO3→KNO3+H2O;
Al(OH)3+3HCl→AlCl3+3H2O.
Реакції між
кислотами і основами називають
реакціями нейтралізації.
5. Взаємодія кислот з
солями
Реакції між
кислотами і солями можливі, якщо в результаті утворюється практично нерозчинна
у воді речовина (випадає осад) або утворюється летка речовина (газ).
- Кислоти реагують
з розчинами солей, якщо в результаті реакції один з
продуктів випадає в осад.
Наприклад, при взаємодії
розчину сульфатної кислоти з розчином барій хлориду в осад випадає барій
сульфат, а при взаємодії розчину натрій силікату з розчином нітратної кислоти в
осад випадає силікатна кислота:
H2SO4+BaCl2=BaSO4↓+2HCl;
Na2SiO3+2HNO3=H2SiO3↓+2NaNO3.
- Продукт
реакції при звичайних умовах, або при нагріванні випаровується.
Наприклад, при дії
концентрованої сульфатної кислоти на кристалічний натрій хлорид, утворюється
газоподібний гідроген хлорид, а при дії хлоридної кислоти на ферум(II)
сульфід виділяється газ гідроген сульфід:
NaCl(т.р.)+H2SO4(конц.)=Na2SO4+2HCl↑;
FeS+2HCl=FeCl2+H2S↑.
Примітка. Скорочення
(т.р.) Означає «тверда речовина», а (конц.) — «концентрований розчин».
- Якщо кислота,
яка вступає в реакцію, є сильнішою, за ту кислоту, що
утворюється.
Наприклад, хлоридна
кислота може витіснити карбонатну з її солі:
2HCl+CaCO3→CaCl2+H2O+CO2↑
01.04.20
ТЕМА: Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів та продуктів реакцій.
Переглянути презентацію, вирішити задачі, домашнє завдання: задачі з презентації + підручник параграф №31, виконати завдання №5,7.
06.04.20.
ТЕМА: Фізичні властивості основ, їх поширеність та використання. Хімічні властивості лугів.
Параграф підручника № 32,33 , виконати завданя с.171 № 2,5, с.180 №3,14.
Основи – це сполуки, до складу яких входять атом металічного елемента й одна або кілька гідроксильних груп OH (залежно від валентності металу).
З точки зору теорії кислот та основ Арреніуса основам можна дати таке визначення: основи — це складні речовини, які у водних розчинах дисоціюють з утворенням гідроксид-іонів ОН-.
Загальна формула основ: Me(OH)n, де n – число груп OH, що відповідає валентності металічного елемента, Me – символ металічного елемента.
Загальна формула основ: Me(OH)n, де n – число груп OH, що відповідає валентності металічного елемента, Me – символ металічного елемента.
Назва основ
Назва основ складається з двох слів, перше з яких – назва металічного елемента, а друге – «гідроксид».
Наприклад, KOH – калій гідроксид, Ba(OH)2 – барій гідроксид.
|
Якщо елемент має кілька значень валентностей, то це значення вказується у назві гідроксиду:
Fe(OH)2 – ферум(II) гідроксид, Fe(OH)3 – ферум(III) гідроксид. |
Тривіальні назви:
NaOH – їдкий натр, каустична сода;
KOH – їдкий калі; Ba(OH)2 – баритова вода; Ca(OH)2 – гашене вапно, вапняне молоко, вапняна вода; NH4OH – нашатирний спирт. |
Фізичні властивості основ
Основи за звичайних умов є твердими речовинами йонної будови, тому вони повинні мати високу температуру плавлення, але при помірному нагріванні майже всі основи розкладаються на відповідний оксид і воду. Розплавити можна лише гідроксиди натрію і калію. Більшість основ не розчиняються у воді. Малорозчинними є гідроксиди малоактивних металічних елементів, а добре розчинні гідроксиди лужних елементів і сполуки барію. Водорозчинні основи називають лугами.
Класифікація основ (записати схему)
Практичне застосування деяких основ
NaOH – у великій кількості використовується у нафтовій промисловості для очищення нафтопродуктів переробки нафти, в миловарній, паперовій, текстильній промисловостях, у виробництві штучного шовку та в ряді інших виробництв. Кип’ятінням деревини з NaOH добувають целюлозу. Обробка бавовняних тканин натрій гідроксидом поліпшує їх здатність до фарбування. Натрій гідроксид – важливий реактив у аналітичній хімії.
КОН – застосовують у миловарній промисловості для виготовлення рідкого мила. Внаслідок великої гігроскопічності його використовують як осушувач, для вбирання вуглекислого газу, у хірургії для припікання, як вихідний продукт для добування різних солей калію.
Ca(OH)2 – відомий під назвою «гашене вапно», широко використовують у будівництві. Суміш гашеного вапна з піском і водою називають вапняним розчином і використовують для скріплення цегли під час мурування цегляних стін, а також як штукатурка. Вапняний розчин твердне спочатку внаслідок випаровування води, а потім – внаслідок вбирання гашеним вапном з повітря вуглекислого газу й утворення кальцій карбонату. Ca(OH)2 використовують для добування хлорного вапна [Са(ОН)2 + Сl2 → CaOCl2 + H2O]. Як «вапняну воду» застосовують для білення, у медицині проти опіків або як протиотруту при отруєннях сульфатною чи оксалатною кислотами.
Ba(OH)2 – насичений водний розчин відомий як «баритова вода», є важливим лабораторним реактивом для виявлення
СО2, йонів SO42– та СO32– та відносно дешевою розчинною основою.
NH4OH – один з найважливіших хімічних реактивів, розбавлений розчин якого «нашатирний спирт» застосовують як слабку основу в хімічній практиці, у медицині, домашньому господарстві.
За звичайних умов луги – це тверді кристалічні речовини, милкі на дотик, роз’їдають багато матеріалів, шкіру, папір, тканину, добре розчиняються у воді.
Хімічні властивості лугів
1. Змінюють колір індикаторів (записати):
- лакмус (фіолетовий) змінюється на синій;
- метиловий оранжевий (оранжевий) – на жовтий;
- фенолфталеїн (безбарвний) забарвлюється в малиновий колір.
- універсальний індикатор(жовтий) стає синім.
2. Луги взаємодіють з кислотами, утворюючи сіль і воду.
Реакції обміну між лугами і кислотами називають реакціями нейтралізації.
Наприклад, при взаємодії натрій гідроксиду з хлоридною кислотою утворюється натрій хлорид і вода:
Якщо нейтралізувати кальцій гідроксид нітратною кислотою, утворюється кальцій нітрат і вода:
3. Луги взаємодіють з кислотними оксидами, утворюючи сіль і воду.
Наприклад, при взаємодії кальцій гідроксиду з карбон(IV ) оксидом (вуглекислим газом), утворюється кальцій карбонат і вода:
↓+H2O
Зверни увагу!
За допомогою цієї хімічної реакції можна довести наявність карбон(IV ) оксиду: при пропусканні вуглекислого газу через вапняну воду (насичений розчин кальцій гідроксиду), розчин мутніє, оскільки випадає осад білого кольору — утворюється нерозчинний кальцій карбонат.
При взаємодії натрій гідроксиду з фосфор(V ) оксидом утворюється натрій ортофосфат і вода:
4. Луги можуть взаємодіяти з розчинними у воді солями.
Зверни увагу!
Реакція обміну між основою і сіллю можлива лише у тому випадку, якщо обидві вихідні речовини є розчинними у воді, а в результаті реакції утворюється хоча б одна нерозчинна речовина (випадає осад).
Наприклад, при взаємодії натрій гідроксиду з купрум(II ) сульфатом утворюється натрій сульфат і купрум(II ) гідроксид, який випадає в осад:
↓
08.04.20.
ТЕМА: Хімічні властивості нерозчинних основ і амфотерних гідроксидів.
Підручник параграф №33,39 , виконати завдання с.216 №7,8.
Хімічні властивості нерозчинних основ:
1. Термічний розклад
Нерозчинні основи на відміну від лугів розкладаються під час нагрівання на основний оксид і воду.
2Fe(OH)3 =ț Fe2O3 + 3H2O
Cu(OH)2 = ț CuO + H2O
Fe(OH)2 = ț FeO + H2O
2. Взаємодія з кислотами
Нерозчинні основи взаємодіють з кислотами, утворюючи сіль та воду.
Mn(OH)2 + 2HNO3 = Mn(NO3)2 + 2H2O
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Розгляньте порівняльну таблицю хімічних властивостей лугів та нерозчинних основ:
Амфотерні гідроксиди
Кислотні властивості виявляють переважно сполуки неметалічних елементів, а основні — металічних елементів. Якщо елемент перебуває на межі між металічними та неметалічними елементами, то цілком очікувано, що його сполуки мають виявляти властивості, характерні як для кислотних, так і для основних речовин. Такі сполуки називають амфотерними.
Амфотерністю називають здатність деяких хімічних сполук залежно від умов (доданих реагентів) виявляти або основні, або кислотні властивості.
Наприклад, з кислотами гідроксиди Алюмінію та Цинку реагують як основи, з лугами - як кислоти.
Запишіть які гідроксиди належать до амфотерних:
Усі рівняння реакції необхідно записати у зошит + вказати № реакції та з чим відбувається взаємодія ( виділено червоним кольором).
1) Під час взаємодії з кислотами амфотерні гідроксиди поводяться як звичайні нерозчинні основи. Тобто продуктами реакції амфотерного гідроксиду з кислотою є сіль і вода:
Zn(OH)2+ 2НСl = ZnCl2 + 2Н2O
2) Під час взаємодії з іншими основами амфотерні гідроксиди виявляють кислотні властивості. Тобто з основами амфотерні гідроксиди реагують, як кислоти: вступають у реакцію з утворенням солі. Але склад солі залежить від умов, за яких відбувається взаємодія: у розчині чи при сплавлянні.
2.1. У розчинах амфотерні гідроксиди взаємодіють тільки з лугами з утворенням складних (комплексних) солей.Наприклад, цинк гідроксид з натрій гідроксидом реагує за рівнянням:

Подібно до цинк гідроксиду реагує з лугами й алюміній гідроксид. Але залежно від концентрації лугу з алюміній гідроксиду може утворитися тетрагідроксоалюмінат (з розбавленим розчином лугу) або гексагідроксоалюмінат (з концентрованим розчином):
Аl(ОН)3 + NaOH = NaAl(OH)4
Аl(ОН)3 + 3NaOH = Na3Al(OH)6
2.2 При сплавлянні амфотерні гідроксиди можуть взаємодіяти не тільки з лугами, а й з нерозчинними гідроксидами. При цьому утворюються також солі, але з більш звичним складом:

Як і в розчинах, з алюміній гідроксиду можуть утворитися дві різні солі залежно від кількості доданого лугу:

2.3. При сплавлянні амфотерні гідроксиди можуть взаємодіяти також і з основними оксидами:

Для того щоб правильно записати рівняння реакції за участю амфотерних гідроксидів при сплавлянні, амфотерні гідроксиди необхідно розглядати як кислоти. Так, формулу цинк гідроксиду Zn(OH)2 можна записати як формулу кислоти Η2ΖnO2. Ця кислота буде мати назву «цинкатна», вона має кислотний залишок ΖnO2 із зарядом -2, її солі — цинкати. Так само формулу алюміній гідроксиду можна записати Н3АlO3: кислотний залишок АlO3 із зарядом -3, солі — ортоалюмінати. Якщо з алюміній гідроксиду прибрати одну молекулу води, то формула кислоти буде НАlO2: кислотний залишок АlO2 із зарядом -1, а солі — метаалюмінати.
13.04.20.
Тема: Контрольна робота з тем "Оксиди. Кислоти. Основи".
15.04.20.
Тема: Фізичні властивості середніх солей. Поширеність у природі та використання середніх солей. Вплив на довкілля і здоров’я людини.
Підручник параграф №37 , виконати завдання для засвоєння матеріалу №1,4.











Склад і формули солей. До класу солей належить сполука, яку ми використовуємо щодня. Це — кухонна сіль NaCl. Вам відомо, що вона складається з йонів Na+ і Сl-. На дошці ви пишете крейдою СаСО3. Її також зараховують до солей. У крейді містяться йони Са2+ і СО2-3.
Солі — сполуки, до складу яких входять катіони металічних елементів та аніони кислотних залишків.
Залежно від складу розрізняють такі типи солей: середні, кислі (основи взято менше) та основні. Також виділяють подвійні, змішані та комплексні солі.
Запишіть схему:
Середні солі при дисоціації дають тільки катіони металу і аніони кислотного залишку. Вони виступають продуктом повного заміщення атомів водню відповідної кислоти на атоми металу.
Йон кислотного залишку має негативний заряд, значення якого збігається зі значенням валентності залишку:

Солі, як і кислоти, мають дві загальні формули — МmАn і Мm(ЕОn)p. Першій формулі відповідають солі, що містять йони кислотних залишків безоксигенових кислот, а другій — солі, аніони яких походять від оксигеновмісних кислот. Приклади формул солей: LiF, CaS, NaNO3, Al2(SO4)3.
Солі
MmAn
Мm(ЕОn)р
Для того щоб скласти формулу солі, потрібно знати заряди катіона й аніона, а також зважати на те, що сполука є електронейтральною. Для з’ясування значень зарядів йонів можна застосовувати таблицю розчинності неорганічних сполук (форзац II).
У солях, завдяки їхньому складу, існує йонний зв’язок, а всі солі мають йонні кристалічні ґратки. І саме тому всі солі за звичайних умов є твердими кристалічними речовинами з високими температурами плавлення (див. Додаток 1). Солі відрізняються за розчинністю: одні солі добре розчинні у воді, інші — майже не розчиняються. Щоб дізнатися про розчинність тієї чи іншої солі, можна скористатися таблицею розчинності речовин у воді (див. форзац 2).
Назви солей. Кожна сіль має хімічну назву, а деякі солі — ще й тривіальні назви.
Формули та назви деяких солей
Формула
|
Хімічна назва кислоти
|
Назва солі
| ||
солі
|
відповідної кислоти
|
хімічна
|
тривіальна
| |
KNO3
|
HNO3
|
Нітратна
|
Калій нітрат
|
Калійна селітра
|
К2СО3
|
H2CO3
|
Карбонатна
|
Калій карбонат
|
Поташ
|
CaF2
|
HF
|
Фторидна
|
Кальцій фторид
|
Флюорит (мінерал)
|
FeCl2
|
HCl
|
Хлоридна
|
Ферум(ІІ) хлорид
|
—
|
Fe2(SO4)3
|
H2SO4
|
Сульфатна
|
Ферум(ІІІ) сульфат
|
—
|
Хімічна назва солі складається із двох слів. Перше слово є назвою металічного елемента, а друге походить від хімічної назви відповідної кислоти. Якщо металічний елемент утворює катіони з різними зарядами, то значення заряду катіона солі вказують після назви елемента римською цифрою в дужках.

За відмінками змінюється лише друге слово хімічної назви солі.
• Дайте хімічні назви солям, що мають такі формули: KF, РbСО3, Ва3(РО4)2, СrСl3.
Існують солі, які походять від амонійної основи NH4OH. До їх складу входять катіони амонію NH+4. Приклади формул і назв таких сполук:
NH4Cl — амоній хлорид;
(NH4)2SO4 — амоній сульфат;
NH4NO3 — амоній нітрат.
Дві останні сполуки застосовують як азотні добрива.
Поширеність солей у природі. До складу земної кори входить багато солей. Більшість із них — силікати. Серед них є й дорогоцінні камені: блакитний топаз (алюміній силікат), золотистий циркон (цирконій силікат), безбарвний фенакіт (берилій силікат) тощо.

Кристали деяких мінералів
Існує багато покладів натрій хлориду NaCl (кам’яна сіль), калій хлориду КСl, кальцій карбонату СаСО3 (крейда, вапняк, мармур). Ця сполука Кальцію становить основу черепашок, коралів, яєчної шкаралупи. Сульфіди ZnS, Cu2S, PbS та інші є рудами; із них добувають метали.

Кальцій карбонат у живій природі
Різні солі містяться в розчиненому стані в гідросфері. У морській воді переважають хлориди Натрію і Магнію, а у прісній — солі Кальцію і Магнію (переважно карбонатної та сульфатної кислот).
22.04.20.
ТЕМА:Хімічні властивості середніх солей.
Параграф підручника №38, виконати завдання № 7,10.
Запишіть загальну схему:
Солі беруть участь у різних реакціях із простими і складними речовинами.
Запишіть рівняння реакції для кожного типу взаємодії солей з іншими речовинами.
Реакції з металами. Сіль у водному розчині може реагувати з металом з утворенням нової солі та іншого металу (мал. 64). Часто кажуть, що один метал «витісняє» інший із солі. Реакція відбувається, якщо метал-реагент активніший за метал-продукт, тобто знаходиться в ряду активності зліва від нього (форзац II):
Pb(NO3)2 + Ζn = Ζn(ΝΟ3)2 + Pb.

Мал. 64. Результат реакції між розчином плюмбум(ІІ) нітрату і цинком
Реакції з лугами. Реакція між сіллю і лугом відбувається лише в розчині (нерозчинні солі з лугами не взаємодіють). Вона можлива, якщо один із її продуктів — основа чи сіль — є нерозчинним у воді (мал. 65):
MnCl2 + 2NaOH = Μn(OΗ)2↓ + 2NaCl;
K2SO4 + Ba(OH)2 = 2KOH + BaSO4↓.

Мал. 65. Реакція між манган(ІІ) хлоридом і натрій гідроксидом у розчині
Для прогнозування можливості таких реакцій використовують таблицю розчинності.
Реакції з кислотами. Сіль (як розчинна, так і нерозчинна) може взаємодіяти з кислотою з утворенням нової солі й нової кислоти. Такі реакції часто відбуваються з виділенням осаду (мал. 66) або газу
CuSO4 + H2S = CuS↓ + H2SO4;
FeS + 2HCl = H2S↑ + FeCl2,
а іноді не супроводжуються зовнішнім ефектом:
NaF + HNO3 = HF + NaNO3.

Мал. 66. Результат реакції між купрум(ІІ) сульфатом і сульфідною кислотою в розчині
Реакції з іншими солями. Взаємодія між двома солями відбувається лише в розчині (реагенти мають бути розчинними у воді) з утворенням двох нових солей. Реакція можлива, якщо один із її продуктів є нерозчинним або малорозчинним; він випадає в осад (мал. 67):
AgNO3 + NaCl = AgCl↓ + NaNO3;
3ВаСl2 + 2К3РО4 = Ва3(РО4)2↓ + 6KCl.

Мал. 67. Реакція між плюмбум(ІІ) нітратом і калій йодидом у розчині
Термічний розклад солей. Оксигеновмісні солі, утворені газуватими, леткими чи нестійкими оксидами, при нагріванні розкладаються. Продуктами більшості таких реакцій є два відповідні оксиди:

Нітрати, як і нітратна кислота, походять від нітроген(V) оксиду Ν2Ο5. Однак під час нагрівання нітратів цей оксид не утворюється через свою нестійкість:

1 Так розкладаються нітрати металічних елементів від Магнію до Купруму включно (див. ряд активності металів).
Солі лужних елементів або не розкладаються під час нагрівання (карбонати, сульфати), або їхній розклад має певні особливості. Деякі з таких реакцій використовують у лабораторії для добування кисню:

27.04.20
ТЕМА: Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів та продуктів реакцій.
Підручник параграф №31.
Вирішити задачі, записати їх у зошит, сфотографувати та надіслати за електронною адресою narina0596@gmail.com





13.05.20.
Параграф №43
18.05.20.
20.05.20.
25.05.20.
27.05.20.
Вирішити задачі, записати їх у зошит, сфотографувати та надіслати за електронною адресою narina0596@gmail.com
1) Обчисліть масу сульфур(VІ) оксиду, необхідну для добування сульфатної кислоти масою 4,9 г.
2) Обчисліть масу гідроген пероксиду, необхіднe для добування кисню об'ємом 5,6 л (н. у.).
3) Який об’єм сірчистого газу SO2 (н. у.) було добуто після спалювання 16 г сірки?
4) Обчисліть об'єм вуглекислого газу (н. у.), необхідний для повного перетворення 37 г кальцій гідроксиду на кальцій карбонат.
29.04.20. 04.05.20.
ТЕМА: Генетичні зв'язки між основними
класами неорганічних речовин.
Параграф №42, виконати № 10, 13.
Генетичні ряди металів і неметалів. Для металів виокремлюють кілька різновидів генетичних рядів.
Схеми запишіть у зошит.
1. Генетичний ряд металу, у якому гідратом оксиду металічного елемента є луг. Цей ряд у загальному вигляді можна зобразити такими перетвореннями:

Наприклад, генетичний ряд літію:
Li → Li2O → LiOH → LiCl.
2. Генетичному ряду, в якому гідратом оксиду металічного елемента є нерозчинна основа, відповідає ланцюжок перетворень:
Зокрема, генетичний ряд міді такий:
Cu → СuО → СuСl2 → Сu(ОН)2 → CuSO4 → Сu.
3. Поміж неметалів також можна виокремити два різновиди генетичних рядів. Генетичний ряд неметалів, де ланкою ряду є розчинна оксигеновмісна кислота. Ланцюжок перетворень такий:

Наприклад: Р → Р2О5→ Н3РО4 → Li3PO4.
4. Генетичний ряд неметалів, де ланкою ряду є нерозчинна оксигеновмісна кислота. Ланцюжок перетворень такий:
Наприклад: Si → SiO2 → Na2SiO3 → H2SiO3 → SiO2.
Отже, існують два основних шляхи генетичних зв’язків між неорганічними речовинами: один з них починається металами, другий - неметалами.

06.05.20.
ТЕМА: Практична робота №2.
Дослідження властивостей основних класів
неорганічних сполук.
Практичну роботу необідно оформити наступним чином: записати дату, "Практична робота №2" нижче записати тему та мету роботи (вона є на відео).
Перегляньте відео демонстрації дослідів. Під час перегляду можете призупиняти відео. Запишіть окремими блоками "Добування і хімічні властивості нерозчинних гідроксидів" , "Добування і хімічні властивості солей" і тд. Під кожним заголовком блоку вам необхідно записати відповідні рівняння реакцій (вони є на відео) + спостереження, а саме які зміни відбуваються. В кінці практичної роботи вам треба оформити висновок, в якому дати відповідь на питання, що розміщені на с.229 вашого підручника.
Виконану практичну роботу необхідно сфотографувати та надіслати фото за електронною адресою: narina0596@gmail.com . У розділі ТЕМА будь ласка вкажіть "8 клас Практична робота Своє прізвище та ім'я"
13.05.20.
ТЕМА: Практична робота №3.
"Розв'язування експериментальних задач".
18.05.20.
ТЕМА: Представлення результатів
навчальних проектів.
Обрати одну тему з переліку та підготувати проект у вигляді електронної презентації чи роботі на арукуші формату А4/А3 з малюнками, ілюстраціями (фото) та короткою інформацією з обраної теми. Презентацію чи фото вашої роботи надістати за електронною адресою narina0596@gmail.com.
1) Неорганічні речовини - представники основних класів у будівництві і побуті.
2) Хімічний склад і використання мінералів.
3) Вплив хімічних сполук на довкілля і здоров'я людини.
20.05.20.
ТЕМА: Контрольна робота з теми "Основні
класи неорганічних сполук".
25.05.20.
ТЕМА: Повторення. Розв'язок
розрахункових задач.
27.05.20.















Комментариев нет:
Отправить комментарий