У робочих зошитах записуємо дату, тему уроку.
Все, що виділено червоним кольором необхідно записати. Малюнки та таблиці за необхідності записати (це буде вказано).
З 24.05.20. результати проектів, практичних робіт, тестів НЕ ПРИЙМАЮТЬСЯ.Розділ: Оксигеновмісні органічні речовини
13.03.2020
ТЕМА: Поняття про спирти, карбонові кислоти, жири, вуглеводи. Метанол, етанол, гліцерол: молекулярні і структурні формули, фізичні властивості.
Параграф підручника № 30, 32, виконати завдання №364,387.
Органічні сполуки, що містять у своєму складі
атоми Оксигену, називаються оксигеновмісними.
Оксиген, як правило, входить до складу органічних
сполук у вигляді груп атомів. Такі групи атомів називають функціональними
групами.
Функціональні групи – це групи атомів, що
визначають хімічні й фізичні властивості речовин.
Наприклад:
-OH – гідроксильна група;
-COH – карбонільна;
-COOH – карбоксильна.
Записати схему:
Записати схему:
 |
| Класифікація оксигеновмісних органічних речовин |
До складу сполук може входити одна або кілька
функціональних груп (однакових або різних).
Органічні речовини, молекули яких містять одну
або кілька функціональних гідроксильних груп, з’єднаних з вуглеводнями,
називаються спиртами.
Спирти — це похідні вуглеводнів, у молекулах яких
один або декілька атомів Гідрогену заміщені на гідроксогрупу.
Гідроксогрупа —OH є функціональною групою
спиртів, яка визначає їхні властивості.
Загальна формула спиртів – R(OH)n.
Якщо у формулі n=1, то такі спирти називають одноатомними, наприклад C2H5OH – етанол. Значенню n=2 відповідають двоатомні спирти, наприклад CH2OH–CH2OH – етиленгліколь, або етанді-1,2-ол, а значенню n=3 – триатомні спирти, наприклад гліцерол.
Загальна формула спиртів – R(OH)n.
Якщо у формулі n=1, то такі спирти називають одноатомними, наприклад C2H5OH – етанол. Значенню n=2 відповідають двоатомні спирти, наприклад CH2OH–CH2OH – етиленгліколь, або етанді-1,2-ол, а значенню n=3 – триатомні спирти, наприклад гліцерол.
Записати схему (структурні формули без малюнків):
Фізичні
властивості. Метанол CH3OH – безбарвна
рідина з температурою плавлення -97,9 °С та температурою кипіння 64,5 °С, густиною
0,7917 г/мл, легко змішується з водою в будь-якому співвідношенні.
Етанол CH3–CH2OH – безбарвна рідина з t = -114,15°С та t = 78,4 °С, густиною 0,7935 г/мл,
розчиняється у воді й органічних розчинниках.
Гліцерол HOCH2CH(OH)CH2OH – безбарвна масляниста рідина
без запаху, має солодкий смак, t = -17,9°С, t = 290 °С, густина 1,2604 г/мл,
гігроскопічна речовина.
Карбоновими кислотами називаються органічні сполуки, в молекулах яких містяться одна або кілька карбоксильн их груп –СООН, сполучених з вуглеводневим радикалом.
Записати схему:
Карбонові кислоти містяться в рослинних та тваринних організмах у вільному (лимонна, щавлева, яблучна, мурашина) і зв’язаному (у вигляді складних ефірів, ефірних масел та жирів – оцтова, масляна, стеаринова, олеїнова тощо) станах.
Жири – це повні естери триатомного спирту гліцерину та вищих жирних (аліфатичних) монокарбонових кислот.
Записати:
Поширення в природі. Жири входять до складу рослинних і тваринних організмів. У тварин жири містяться у підшкірній тканині та молоці, у рослин вони накопичуються в пледах, зерні.
Жири – це повні естери триатомного спирту гліцерину та вищих жирних (аліфатичних) монокарбонових кислот.
Записати:
 |
| Загальна формула жирів |
Крім тригліцеридів до складу природних жирів входять різні домішки: вільні жирні кислоти, моно- та дигліцериди, вітаміни тощо.
Фізичні властивості. Жири бувають тверді та рідкі. Тверді утворені алкановими кислотами, рідкі – алкеновими. Жири тваринного походження є переважно твердими речовинами (овечий, яловичий), рослинного походження – рідкими (кукурудзяна, маслинова, соєва, соняшникова олії). Жири, як правило, легші за воду, не розчиняються в ній, але утворюють емульсії, добре розчиняються в органічних розчинниках (ефірі, бензолі, бензині тощо). Жири утримують і легко поглинають пахучі речовини. Ця властивість використовується для добування пахучих речовин з квітів. Температура плавлення жирів чітко не визначена, оскільки вони не мають постійного складу.
Використання. Жири як одна з головних складових частин раціону харчування людини та тварини необхідні для забезпечення нормальної життєдіяльності. В організмі під дією ферментів вони гідролізуються, потім з продуктів гідролізу синтезуються нові жири, характерні для даного організму.
Велика кількість жирів використовується для виробництва мила, гліцерину, карбонових кислот, плівкоутворювачів (оліф, лаків), а також у фармацевтичній та косметичній промисловості.
Вуглеводи – це органічні речовини, що складаються з карбону, оксигену й гідрогену та належать до класу полігідроксикарбонільних сполук.
Багато вуглеводів має склад, що відповідає загальній формулі Сn(H2О)m, але відомі також вуглеводи іншого складу. Разом з тим, цією формулою можна описати склад деяких органічних сполук, які не належать до вуглеводів (оцтова кислота С2Н4О2, формальдегід СН2O).
Записати:
Поширення у природі. Вуглеводи утворюються в зелених рослинах у результаті фотосинтезу з оксиду вуглецю (IV) та води. їх масова частка становить близько 80 % сухої маси речовини рослин і до 2 % – тваринних організмів.
Вуглеводи відіграють важливу роль у житті людини. Як і жири, вони є джерелом енергії в організмі. їжа людини приблизно на 70 % складається з вуглеводів.
Вуглеводи є сировиною для виготовлення паперу, тканин.
У природі найбільш поширені правообертаючі глюкоза, галактоза, маноза, сахароза, лівообертаюча фруктоза.
18.03.20
ТЕМА: Горіння етанолу.
Якісна реакція на гліцерол.
Параграф підручника № 30, 32 (повторити), виконати завдання №369,370,371.
Метанол, етанол та гліцерол вступають у реакції повного окиснення, унаслідок
яких утворюються карбон (ІV) оксид і вода. Записати:
Пригадайте:
Метанол (метиловий
спирт, карбінол) СН3ОН – найпростіший одноатомний спирт, безбарвна легкорухлива
рідина з температурою плавлення 97 °С, кипіння 64,7 °С. Він є сильною отрутою
(вживання невеликої кількості викликає втрату зору, великої – смерть).
Етанол (етиловий
спирт) СН3СН2ОН– безбарвна горюча рідина. Температура кипіння 78,3 °С,
замерзання – 114 °С. Ця речовина змішується з водою в будь-яких
співвідношеннях.
Гліцерол
− безбарвна сиропоподібна, дуже в’язка рідина, не отруйна, tпл. = 17,8 °С,
tкип. = +290 °С. Нелеткий, важчий за воду, необмежено розчиняється у воді
(змішується в будь-яких співвідношеннях). Дуже гігроскопічний (поглинає водяну
пару з повітря), солодкий на смак.
Щоб девести наявність тієї чи іншої речовини використовують якісні реакції.
Перегляньте відео, в якому демонструють якісну реакцію на гліцерол.
Запишіть результати своїх простережень у вигляді наведеної таблиці:
20.03.20
ТЕМА: Отруйність метанолу й етанолу. Згубна дія алкоголю на організм людини.
Параграф підручника № 31, виконати завдання №374.
Усі одноатомні спирти — отруйні речовини. Помічено, що зі збільшенням числа атомів Карбону в молекулі токсичність спиртів збільшується. Утім, хоча в молекулі метанолу число атомів Карбону найменше, він є найотруйнішим серед спиртів. Уживання лише 25 мл метанолу може призвести до смерті людини, а менша кількість спричиняє ураження зорового нерва та, як наслідок, сліпоту.
Це пояснюється тим, що, потрапляючи в організм людини, метанол (як і будь-яка отрута) окиснюється в печінці до формальдегіду. Більшість отруйних речовини у разі окиснення стають безпечними, але токсичність формальдегіду набагато вища за будь-який спирт. Потрапляючи в мозок, він насамперед уражає нервову тканину. Це приводить до розвитку сліпоти, а згодом, і смерті.
Небезпека також полягає в тому, що за запахом метанол та етанол майже не відрізняються, і в деяких випадках їх можна сплутати і випити метанол. Першим симптомом отруєння метанолом є погіршення зору. Необхідно промити шлунок, випити етанол (він є протиотрутою) та якомога швидше звернутися по медичну допомогу.
Згубна дія етанолу на організм людини
Етанол у природі утворюється під час спиртового бродіння глюкози за наявності грибів — дріжджів. Саме завдяки цьому процесу людство вперше відкрило алкоголь та алкогольні напої (алкоголі — це англомовна назва спиртів).
Етанол — головний компонент алкогольних напоїв, саме він є причиною небезпечних наслідків їх уживання. У різних сортах пива міститься від 4 до 9 % етанолу, у вині — від 10 до 13 %, у міцних спиртних напоях — 40 % і більше. Смак алкогольних напоїв залежить не від концентрації етанолу, а від наявності домішок.
Етанол, як і всі спирти, є отруйною речовиною. Уживання великої кількості етанолу або алкогольних напоїв може призвести до гострого алкогольного отруєння. Залежно від дози та концентрації етанол виявляє наркотичну (або токсичну) дію. Під наркотичною (токсичною) дозою розуміють мінімальну дозу, за якої виникають симптоми отруєння. Під час наркотичного алкогольного отруєння виникає ступор, знеболення, пригнічується діяльності центральної нервової системи. Наркотична доза етанолу становить 1-4 г на 1 кг маси тіла. Як і будь-яку отруту, організм намагається знешкодити етанол, але під час цього етанол перетворюється на ацетальдегід, який виявляє набагато сильнішу токсичну дію й пошкоджує ДНК. Велика кількість випитого алкоголю може спричинити смерть (смертельна разова доза становить 4-12 г спирту на 1 кг маси тіла).
Постійне вживання алкогольних напоїв призводить до тяжкого захворювання — алкоголізму, що є причиною соціальної деградації особистості й ураження внутрішніх органів: цирозу печінки, виразки шлунка тощо.
Найбільш вразливим до дії алкоголю є організм підлітків, оскільки у віці 12-17 років закінчують формуватися основні органи, і вживання алкоголю (у тому числі вина й пива) може спричинити патології шлунка, печінки, мозку тощо, що впливає на ріст і загальний розвиток, знижує опірність інфекціям. Особливо вразливою до дії алкоголю є статева система підлітків, порушення нормального розвитку якої в цьому віці може спричинити серйозні патології й навіть безпліддя. У підлітковому віці активно розвивається психіка, і навіть одноразовий прийом алкоголю порушує її нормальний розвиток: збільшується агресивність, погіршується пам’ять і здатність виконувати елементарні арифметичні дії, втрачається здатність викласти прочитане своїми словами. Алкоголь пригнічує процеси гальмування нервової системи, тому людина втрачає контроль над поведінкою, знижується її критичне ставлення до себе. Перебуваючи під дією алкоголю, людина здатна на вчинки, наслідки яких можуть бути жахливими.
Токсична дія алкоголю на організм підлітка в декілька разів сильніша, ніж на дорослий організм, завдяки більш інтенсивному обміну речовин. За концентрації алкоголю в крові 0,5-0,6 % (відповідає 0,5 л горілки) у підлітка може настати смерть.
Пам’ятайте, що алкоголь є реальною небезпекою для вашого здоров’я й майбутнього в цілому!
Етиловий спирт — наркотична речовина, тобто виявляє певну знеболюючу дію. Завдяки цьому в часи Другої світової війни його використовували як наркоз під час хірургічних операцій. Однак етиловий спирт є дуже небезпечним. Як у будь-якої наркотичної речовини, в нього є як знеболююча, так і смертельна доза, причому для етанолу різниця між цими дозами дуже незначна: якщо пацієнт вип'є трохи менше, буде боляче, а якщо трохи більше — він помре.
Ключова ідея
Етиловий спирт виявляє дуже сильну наркотичну й токсичну дію на організм людини і спричиняє ураження багатьох органів і систем. Особливо небезпечний алкоголь у підлітковому віці.
01.04.20
ТЕМА: Етанова (оцтова) кислота, її молекулярна і
структурна формули, фізичні властивості. Хімічні властивості етанової кислоти: електролітична
дисоціація, дія на індикатори, взаємодія з металами, лугами, солями.
Параграф №33, виконати завдання №401,402,404.
Карбоновими кислотами називають похідні вуглеводнів, у молекулах яких міститься карбоксильна група -СООН.
Загальна формула:
СnH 2n+1COOH
або СnH2nO2
Запишіть:
просторовий вигляд молекули електронна формула
Фізичні властивості оцтової кислоти (записати):
Ознаки
|
Властивості
|
1.Колір
|
Безбарвна, прозора
|
2. Смак
|
Кислий смак
|
3. Запах
|
Різкий запах
|
4. Розчинність
|
Необмежено розчиняється
|
5. Густина
|
1,05 г/см
|
6.Температура кипіння
|
118,1
|
7. Температура плавлення
|
16,6
|
8.Теплопровідність
|
Проводить тепло
|
9. Електропровідність
|
Слабкий електроліт
|
10. Агрегатний стан при нормальних умовах.
|
Рідина
|
Хімічні властивості (запишіть основні рівняння реакції, їх назви, які демонструють властивості етанової кислоти)
2.
Взаємодія оцтової (або етанової) кислоти з металами ( у ряді М. Бекетова до
гідрогену) з утворенням солі та
водню:
2СН3СООН + Zn → (СН3СОО)2Zn + Н2↑ (зверніть увагу де може ставитися Ме у солі оргкислоти).
СН3СООН + Сu → реакція
не відбувається (Ме після (Н))
3. Взаємодія оцтової (або етанової) кислоти з лугами:
СН3СООН +
КОН = СН3 СООК + Н2О
4. Взаємодія оцтової (або етанової) кислоти з солями:
Чи взаємодіє оцтова кислота з
солями?
Зверніть увагу на ряд сили кислот та спрогнозуйте властивості оцтової кислоти. Ряд сили кислот
( по цьому ряду кожна попередня кислота витісняє наступну кислоту):
Н2SO4; НСl; НNO3; H3PO4;
Н2SО3;
СН3СООН; Н2СО3; Н2S; Н2SiО3
Оцтова кислота реагує лише з деякими солями
слабкіших кислот
а) СН3СООН + Na2SO4 → реакція не відбувається
б) СН3СООН + Na2СO3 → CН3СООNa + СО2↑ + Н2О
4. Взаємодія оцтової (або етанової) кислоти з киснем (реакція горіння):
СН3СООН + 2О2
→ 2СО2↑ + 2Н2О
03.04.20.
ТЕМА: Застосування етанової кислоти.
Параграф №33 повторити
Застосування оцтової кислоти досить різноманітне. У хімічній промисловості з неї виробляють пластмаси, різні барвники, лікарські речовини, штучне волокно (ацетатний шовк), незаймисту кіноплівку та багато інших речовин. Солі оцтової кислоти — ацетати алюмінію, хрому, феруму — застосовують як протраву при фарбуванні тканин. Оцтова кислота має широке застосування і як розчинник.
У харчовій промисловості застосовується як консервант, регулятор кислотності та смакова приправа; в Європейській системі харчових добавок оцтова кислота має код E260.
Кислота застосовується при солянокислотних обробленнях привибійних зон пласта як стабілізатор (з метою стабілізації продуктів реакції) від випадання складновилучуваних гелеподібних сполук заліза (осаду). Залежно від вмісту заліза в кислотному розчині (від 0,01 до 0,5%) беруть 1—3% оцтову кислоту. Для приготування робочих розчинів використовують як синтетичну кислоту, так і лісохімічну технічну очищену.
Запишіть схему:
08.04.20.
ТЕМА: Практична робота "Властивості етанової кислоти".
"/ " - означає наступний рядок
Необхідно оформити практичну роботу на окремому подвійному аркуші наступним чином: не відкриваючи ваш аркуш по середині підписати Практична робота/ з хімії на тему/ Властивості етанової кислоти/ учня(учениці) 9 класу/КЗШ №31/ прізвище ім'я в родовому відмінку.
Після чого відкриваємо ваш подвійний аркуш, на його лівій стороні записуємо дату (Восьме квітня). Нижче вам необхідно переписати всю практичну роботу та виконати завдання до неї.
Мета: експериментальним шляхом довести вивчені
властивості етанової кислоти, розвинути вміння творчого використання набутих
знань, безпечного поводження з речовинами.
Реактиви та обладнання (поруч
із назвами речовин запишіть відповідні формули): розчини етанової кислоти
________, натрій гідроксиду _______, лакмусу,
метилового оранжевого, фенолфталеїну, магній _____, натрій карбонат ______, шпатель, штатив із пробірками.
Що спостерігали
|
Рівняння реакцій в йонно-молекулярній і
йонній формах
|
Дослід №1: Дія на індикатори.
До трьох пробірок з
оцтовою кислотою додайте розчин фенолфталеїну, метил оранжевий та лакмусу. Як
змінилось забарвлення розчину?
|
|
Дослід
№2. Взаємодія оцтової кислоти з основами.
До
розчину гідроксиду натрію (NaОН)
забарвленого фенолфталеїном
додали розчин оцтової кислоти до
знебарвлення розчину індикатора. Про що свідчать результати досліду? Складіть
рівняння реакцій в молекулярній та йонних формах.
|
|
Дослід
№3. Взаємодія оцтової кислоти з металами.
В пробірку всипати невелику кількість
порошка металічного магнію і долити
розчин оцтової кислоти. Спостерігається виділення газу.
Який газ виділяється? Складіть рівняння
реакцій в молекулярній та йонних формах.
|
|
Дослід
№4. Взаємодія оцтової кислоти з солями.
В пробірку всипаємо невелику кількість
натрій карбонату і
Доливаємо розчину кислоти.
Спостерігається бурхливе виділення газу.
Який газ виділяється? Складіть рівняння реакцій у молекулярній та йонних
формах.
| |
Сформулюйте висновок: Дайте відповідь
на запитання: Які властивості етанової кислоти характеризують подібність властивостей органічних і неорганічних кислот? З якою метою під час
приготування тіста питну соду "гасять" оцтом?
10.04.20.
ТЕМА: Вищі карбонові кислоти: стеаринова, пальмітинова, олеїнова.
Мило, його склад, мийна дія.
Підручник параграф № 34, виконати №420
Вищими карбоновими
кислотами називають карбонові кислоти, у молекулах
яких міститься від 12 до 22 атомів Карбону. Як і вуглеводні, вищі карбонові
кислоти можуть бути насиченими та ненасиченими.
З насичених вищих
карбонових кислот найчастіше трапляються стеаринова й пальмітинова кислоти.
Формула стеаринової
кислоти: С17Н35СООН.
Формула
пальмітинової кислоти: С15Н31СООН.
Стеаринова та
пальмітинова кислоти – тверді білі воскоподібні
речовини без запаху, жирні на дотик, нерозчинні у воді, але добре розчинні в
органічних розчинниках, легкоплавкі. Їх використовують для виготовлення свічок,
мастил, косметичних засобів і різних сортів мила.
Ненасичених вищих
карбонових кислот існує набагато більше, ніж
насичених. Серед них найпоширенішими є: олеїнова С17Н33СООН,
лінолева С17Н31СООН, ліноленова С17Н29СООН.
Ненасичені вищі карбонові кислоти – безбарвні або
світло-жовті маслянисті рідини без запаху, нерозчинні у воді, але добре
розчинні в багатьох органічних розчинниках. Їх застосування в техніці
принципово не відрізняється від насичених кислот, але вони набагато цінніші для
людини як поживні речовини у складі жирів.
Мило – це солі вищих
карбонових кислот з Натрієм
або Калієм. До складу мила входять натрієві та калієві солі
вищих карбонових кислот: стеаринової та пальмітинової. Натрієві солі вищих
карбонових кислот є основною складовою частиною твердого мила, калієві солі – рідкого
мила.
Традиційний процес миловаріння полягає в нагріванні жирів або олій із лугом. У результаті утворюється концентрований розчин, у якому містяться солі вищих кислот (мила). При додаванні до нього насиченого розчину кухонної солі розчинність цих солей зменшується; вони виділяються з розчину і спливають на поверхню. Цей процес називають висолюванням. Мило збирають і заповнюють ним форми, де воно твердне. Залежно від сорту мила в нього під час виготовлення додають барвники, ароматизатори, екстракти рослин (календули, липи, ромашки та ін.).
Мийна дія мила полягає у відокремленні часточок бруду, наприклад, від поверхні тканини й утворенні емульсії чи суспензії. Розглянемо, як це відбувається.
Потрапляючи у воду, мило розчиняється і частково взаємодіє з нею; при цьому утворюються слабка кислота і луг:
C17H35COONa + H2O ⇄ С17Н35СООН + NaOH,
С17Н35СОО- + H2O ⇄ С17Н35СООН + OH-.
Аніон С17Н35СОО- складається із двох частин — полярної (-СОО-) і неполярної (С17Н35-) (мал. 84). Неполярна частина йона «розчиняється» в жировій частині забруднення, а полярна залишається у воді (мал. 85), сполучаючись із її молекулами водневими зв'язками. Унаслідок такої взаємодії забруднення відокремлюється від поверхні тканини разом з аніонами кислотних залишків у вигляді маленьких жирових краплинок або твердих часточок. Вони не злипаються, оскільки мають на своїй поверхні однойменний заряд (який?), а збираються навколо бульбашок повітря в піні.

Мал. 84. Масштабна модель аніона вищої карбонової кислоти

Мал. 85. Мийна дія мила: а — сполучення аніонів із часточкою жиру; б — відокремлення часточки жиру від тканини
Використання мила має певні недоліки. Луг, невелика кількість якого утворюється у водному розчині мила, повільно роз'їдає тканини, руйнує деякі барвники. Нині мило майже повністю витіснили синтетичні мийні засоби.
«Історія
мила»
За існуючими даними, мило виготовлялося ще в
стародавньому Шумері та Вавилоні (приблизно 2800 років до н. е.), а Єгипетський
папірус свідчить про те, що єгиптяни регулярно милися за допомогою мила. Одна з
легенд пов’язує появу мила і навіть слова «soap» з горою Sapo, на якій в
Стародавньому Римі спалювали туші принесених в жертву тварин. Жир тварин,
який виділявся під час спалювання такої жертви, накопичувався та змішувався з
попелом вогнищ (як природний луг), а потім змивався дощами в річку, в
результаті чого вода починала пінитися і добре змивати весь бруд з тканини.
Саме тоді помітили той факт, що завдяки цій суміші, одяг почав пратися набагато
легше.
Створення милоподібної напіврідкої речовини «сапо»
дало можливість жінкам використати її не лише для прання, але й для косметичних
цілей: укладки волосся, фарбування. Проте ефект не був довготривалим, оскільки
при попаданні на цю суміш води, утворювалася густа піна і фарба легко
змивалась. Пізніше римляни стали використовувати для варіння жири та природну
соду, без золи. Таку суміш змішували і тримали на вогні до повного
випаровування води, в результаті чого виходили тверді шматки мила. Але мило
виявилося таке жорстке, що його використовували тільки для прання.
Для миття тіла в той час римляни застосовували
спеціальний інструмент – стригли.
Одна з перших
публікацій про мило
зустрічається у «Природній
історії» Плінія Старшого.
Він пише, що мило
виготовляють з букової
золи і козиного
сала, а добули його
гали для фарбування
волосся в червоний
колір. З тексту не
зрозуміло, чи
використовувалось мило для інших
цілей.
У відомому папірусі Еберса – медичний
древньогрецький рукопис, знайдений в
1872 р, до ХІ ст. до н. е. мило
згадується як лікарський
препарат. У документах, що дійшли до
нас із середньовіччя, спогадів про
мило не було. Якщо
в Стародавньому Римі було, як
відомо 800 лазень, то в середині
ІІ тис. Іспанська королева Ізабелла
Католицька пишалась тим, що милась
два рази в
житті: після народження і
перед весіллям. Миловаріння як
ремесло виникло в Європі у XIV ст. В Росії секрети виробництва мила перейняли від Візантії. Майстри миловаріння
появились лише у XV ст. Найвідомішим з них
був Гаврило Андрєєв, який
створив завод в Твері. Перші
синтетичні мийні засоби
зявились в 1916 р. Винахід
німецького хіміка Фріца Понтера мав лише
промислове застосування.
Побутові синтетичні мийні
засоби не шкідливі
для рук стали випускати у 1933р.
15.04.20.
ТЕМА: Жири. Вуглеводи: глюкоза,
сахароза, крохмаль, целюлоза.
Параграф №35, 36, 37. Виконати завдання №447, 450.
Склад i будова молекул. Серед сполук, похідних карбонових кислот, чи не найбільше значення мають ті, що утворені триатомним спиртом гліцеролом i вищими карбоновими кислотами (пригадайте їхні формули і назви).
Жири — це клас органічних сполук, молекули яких складаються із залишків молекул багатоатомного спирту гліцеролу та вищих карбонових кислот.
Якщо вуглеводневу групу молекули карбонової кислоти позначити як R, то формулу жиру можна записати в загальному вигляді, запишіть:

Фізичні властивості жирів. Склад і будова вуглеводневих груп впливають на властивості жирів.
Ось як, наприклад, змінюються їхні температури плавлення:
Склад вуглеводневої групи R
|
Назва жиру
|
tпл, °С
|
—С17Н35
|
Тристеарин
|
65
|
—С17Н33
|
Триолеїн
|
- 4
|
Жир, утворений насиченою кислотою, твердий за стандартних умов, ненасиченою — рідкий (мал. 63).

Мал. 63. Ці продукти містять жири
Рідкі рослинні жири називають ще оліями. До складу олій (соняшникової, кукурудзяної, маслинової тощо) входять залишки переважно ненасичених кислот, до складу тваринних (яловичого, баранячого та ін.) — залишки насичених кислот. У вершковому маслі містяться жири, що утворені насиченими й ненасиченими кислотами.
Жири легші за воду і нерозчинні в ній, але розчиняються в органічних розчинниках.
Запишіть:

Реакція окиснення. Під час тривалого зберігання на повітрі під дією теплоти і світла жири гіркнуть, у них з'являються неприємні запах і смак. Це є результатом процесів окиснення жирів, що супроводжуються утворенням вільних карбонових кислот та інших оксигеновмісних органічних сполук, нерідко шкідливих для здоров'я.
Реакція приєднання. У молекулах рідких жирів на відміну від твердих є подвійні карбон-карбонові зв'язки. За місцем подвійного зв'язку можлива реакція приєднання, зокрема Гідрогену (реакція гідрування). У результаті цієї реакції ненасичена сполука (рідкий жир) перетворюється на насичену (твердий жир).
Гідрування жирів відбувається за такою схемою:

Процес тверднення (гідрування) жирів є основою виробництва маргарину (від грецьк. слова, що означає перлина).
Окиснення негідрованих жирів легше відбувається за подвійними зв'язками, а гідрування уповільнює ці процеси. Крім того, воно уможливлює добування твердих жирів, подібних до вершкового масла.
Для одержання маргарину переробляють дешеві олії, риб'ячий і китовий жири.
Тверді жири мають переваги над рідкими, оскільки не містять подвійних зв'язків, отже, повільніше окиснюються, їх легше транспортувати, фасувати тощо. Для того щоб зробити гідрований жир придатним до вживання, до нього добавляють смакові, ароматичні речовини, барвники.
Біологічне значення жирів. Жири разом із білками та вуглеводами належать до біологічно активних речовин. Вони є складниками клітин рослинних і тваринних організмів і слугують для них джерелом енергії. У результаті окиснення 1 г жиру виділяється 37,7 кДж енергії, що удвічі більше, ніж під час окиснення 1 г білка або вуглеводу.
Основна кількість жирів, що їх споживає людина, міститься у м'ясі, рибі, молочних і зернових продуктах. Якщо в організм людини з їжею надходить більше енергії, ніж вона затрачає, то утворюються жироподібні речовини, що відкладаються в тканинах організму. У такий спосіб організм акумулює енергію.
Згідно з даними сучасної медицини надмірне вживання жирів, утворених насиченими кислотами, тобто тваринних жирів, може призвести до накопичення речовин, що утруднюють рух крові в артеріях, зокрема тих, що постачають кров'ю мозок.
Кориснішими для вживання визнаються жири, утворені ненасиченими кислотами, тобто олії. У складі соняшникової олії, наприклад, міститься 91 % ненасичених карбонових кислот.
Вуглеводи
Вуглеводи поділяють на прості (моносахариди) і складні (дисахариди й полісахариди) . Принципово вони відрізняються тим, що складні вуглеводи за певних умов гідролізуються до простих (розкладаються), а прості вже гідролізуватися не можуть. Молекули дисахаридів складаються із двох, а полісахаридів — з великої кількості залишків молекул моносахаридів. Запишіть:

Досі ви вивчали хімічні реакції, у результаті яких одні органічні сполуки перетворювалися на інші або окиснювалися до вуглекислого газу і води. У природі постійно відбувається зворотний процес: із вуглекислого газу і води утворюються органічні речовини, з яких побудовані рослинні організми. Під дією сонячної енергії у зелених листках рослин відбувається реакція фотосинтезу, внаслідок якої утворюється глюкоза. Процесу сприяє, тобто каталізує його, зелений пігмент хлорофіл, що вбирає сонячну енергію (мал. 64). У загальному вигляді процес фотосинтезу виражається рівнянням:

Мал. 64. Глюкоза утворюється в рослинах у результаті фотосинтезу
У рослинах із глюкози утворюються сахароза, крохмаль і целюлоза. Ці сполуки належать до класу вуглеводів. Така назва склалася історично. Перші з вивчених сполук цього класу містили в молекулах крім атомів Карбону (колишня назва «вуглець») атоми Гідрогену й Оксигену у співвідношенні Н : О, як 2 : 1, подібно до води, — звідси «вуглеводи».
Молекулярна формула глюкози — С6Н12О6. У молекулі глюкози, складну будову якої ми не розглядаємо, є п'ять гідроксильних груп —ОН. Отже, глюкоза — багатоатомний спирт, альдегідоспирт.

Мал. 65. Глюкоза — лікарський засіб
Фізичні властивості. Глюкоза дуже поширена у природі. Це безбарвна кристалічна речовина, добре розчинна у воді, солодка на смак. У вільному стані вона міститься в багатьох фруктах, зокрема у винограді (звідси назва глюкози — виноградний цукор), у меду, є вона і в корінні, листках і квітках рослин, у крові людини і тварин (близько 0,1 %).
У рослинах глюкоза перетворюється на складні вуглеводи — крохмаль і целюлозу:
Сахароза
Найбільше значення серед дисахаридів має сахароза C12H22O11. Це хімічна назва звичайного цукру, що виділяють із цукрового буряку або цукрової тростини.
Сахароза — безбарвна кристалічна речовина без запаху, густина 1,59 г/см3, температура плавлення 186 °С. Сахароза солодка на смак і в півтора раза солодша за глюкозу. Дуже добре розчиняється у воді: у 100 г води за 0 °С розчиняється 179 г сахарози, а за 100 °С — 487 г.
Так само як і глюкоза, сахароза розкладається під час нагрівання:
Як і більшість органічних речовин, сахароза може горіти з утворенням вуглекислого газу й води:
Сахарозу називають дисахаридом, оскільки молекула сахарози складається із залишків молекул двох моносахаридів — глюкози та фруктози, сполучених між собою.
Під час гідролізу сахарози в кислому середовищі або під дією ферментів зв’язок між цими залишками розривається, й утворюються молекули глюкози і фруктози:
Крохмаль
Склад молекули крохмалю виражається загальною формулою (С6Н10О5)n. Крохмаль — природний полімер, що синтезується в рослинах з глюкози за реакцією:
nС6Н12O6 → (С6Н10O5)n + nН2О
Крохмаль міститься в усіх рослинах, а в деяких — у великій кількості. Бульби картоплі містять за масою від 12 до 20 %, пшениця — від 57 до 75 %, рис — від 62 до 80 % крохмалю. Він накопичується в рослинах і використовується ними як джерело енергії, необхідної, наприклад, для проростання насіння.
Фізичні властивості. Крохмаль — білий аморфний порошок. У холодній воді нерозчинний, осідає на дні посудини, у гарячій воді набрякає, утворюючи клейстер.
Накопичений рослинами крохмаль розщеплюється під дією ферментів з утворенням глюкози, у результаті окиснення якої вивільнюється енергія. Якщо рослини запасають енергію у вигляді крохмалю, то тварини — у вигляді глікогену (вуглеводу, близького за структурою до крохмалю).
Целюлоза
Із ланок складу —С6Н10О5—, такого самого, як у крохмалю, складаються ланцюгові молекули іншого природного полімеру — целюлози (від лат. celula — комірка), або клітковини.
Целюлоза дуже поширена у природі, оскільки з неї побудовані оболонки рослинних клітин. Якщо крохмаль — джерело енергії, то целюлоза — будівельний матеріал рослин. Рослинні волокна (бавовняні, конопляні, лляні) і деревина на 45 % складаються з целюлози. Майже чиста целюлоза відома вам у вигляді вати і фільтрувального паперу.
Зовнішня відмінність між цими волокнами i крохмалем очевидна, хоча полімерні ланцюги крохмалю і целюлози побудовані з однакових ланок. Що є причиною такої відмінності? Відповідь однозначна — склад та будова молекул. Загальна формула целюлози, як і крохмалю, — (С6Н10О5)n. Але ступінь полімеризації, молекулярна маса целюлози набагато більші, ніж у крохмалю: n становить 10—14 тисяч, відносна молекулярна маса — кілька мільйонів.
Крім того, частина молекул крохмалю має розгалужену будову, а молекули целюлози ниткоподібні, лінійні, через це вони можуть утворювати волокна.

Зріз оболонки рослинної клітини під електронним мікроскопом (видно волокнисту структуру целюлози)
Є ще й інші істотні особливості внутрішньої будови, які ми не розглядаємо, але вони також зумовлюють відмінності між крохмалем і целюлозою.
Сучасна наука розглядає її як перспективну сировину для добування вуглеводнів та інших органічних речовин. Це досягається методами біотехнології, що передбачають використання ферментів (біохімічних каталізаторів). Добуті в такий спосіб продукти поки що мають порівняно високу вартість, але в майбутньому до нафти, природного газу і кам'яного вугілля як джерел органічних сполук додасться ще й біомаса.
17.04.20.
ТЕМА: Крохмаль і целюлоза - природні
полімери.
Параграф №37, виконати завдання №463
Крохмаль накопичується у плодах, зерні та бульбах деяких рослин як запасна форма вуглеводів: у бульбі картоплі — до 24 %; у зерні кукурудзи — до 72 %, пшениці — до 75 %, рису — до 86 %.
Крохмаль — природний полімер, це суміш молекул двох типів: амілози та амілопектину. Амілоза (20 %) має менші, лінійні молекули і частково розчинна у воді. Молекули амілопектину (80 %) значно більші, розгалужені, вони майже нерозчинні у воді. Якщо розглянути крохмаль під мікроскопом, то можна побачити, що він складається з дрібненьких зерен.

Картопляний крохмаль
Целюлоза, або клітковина, — найпоширеніший вуглевод у рослинному світі, більш поширений, ніж крохмаль. Вона є основною складовою частиною оболонок рослинних клітин, звідси і походить її назва — целюлоза (лат. cellula — клітина).
Вона надає рослинам міцності та еластичності. Целюлоза — тверда волокниста речовина білого кольору, не розчиняється у воді й звичайних органічних розчинниках.
КРОХМАЛЬ І ЦЕЛЮЛОЗА — НАЙПОШИРЕНІШІ ПОЛІСАХАРИДИ У ПРИРОДІ. Це природні полімери, склад яких передається однаковою загальною формулою (С6Н10О5)n. На крохмаль багаті бульби картоплі, зерна злакових рослин. Оболонки рослинних клітин утворені із целюлози. Вона є своєрідним скелетом рослин, надає їхнім тканинам механічну міцність. Тому целюлоза становить основу стовбурів дерев (50 % і більше), рослинних волокон. Понад 90 % вмісту коробочок рослини бавовнику припадає на целюлозу. Великим є вміст целюлози у стеблах конопель, тому наші предки здавна вирощували коноплі, з яких за спеціальною технологією виготовляли пряжу, а вже з неї шили полотняний одяг, робили вітрила кораблів тощо.
У ХІХ ст., невдовзі після завезення картоплі з американського континенту до України, українці навчилися виділяти з неї крохмаль і вживати його в їжу у вигляді молочного чи фруктового киселю, застосовувати для накрохмалювання тканин. Підкрохмалена тканина не лише цупка, а й краще захищена від глибокого проникнення в неї бруду, її легше прати.
ВІДМІННОСТІ У ВЛАСТИВОСТЯХ КРОХМАЛЮ ТА ЦЕЛЮЛОЗИ. Порівняння порошку крохмалю й вати, яка майже на 98 % складається із целюлози, переконливо доводить, що це різні речовини, хоча вони мають однакову загальну формулу. Чим зумовлена відмінність між крохмалем і целюлозою? По-перше, ступенем полімеризації — у целюлози він значно більший. Тому відносна молекулярна маса целюлози теж більша. По-друге, просторовою будовою структурної ланки. По-третє, будовою полімерного ланцюга — у целюлози він лише лінійний (мал. в), тоді як у крохмалю є дві форми ланцюга — пряма (10-20 % макромолекул) (мал. а) та розгалужена (80-90 % макромолекул) (мал. б).

Будова крохмалю та целюлози: а, б — схеми лінійної та розгалуженої молекул крохмалю; в — лінійні молекули целюлози
Розгалужена будова молекул крохмалю не дає змоги виготовляти з нього нитки. Целюлоза піддається скручуванню та згинанню, тобто з неї легко виготовити пряжу, а з пряжі — тканини. Крохмаль у гарячій воді перетворюється на колоїдний розчин — крохмальний клейстер. Приготування фруктового киселю базується на цій властивості крохмалю.
ЯКІСНА РЕАКЦІЯ НА КРОХМАЛЬ
Якісною реакцією на крохмаль є взаємодія з розчином йоду. Утворюється сполука, що має характерне синє забарвлення.
Під час нагрівання до 100 °С утворена сполука руйнується й синє забарвлення зникає, при охолодженні з'являється знову.
ЗАСТОСУВАННЯ Й БІОЛОГІЧНА РОЛЬ ВУГЛЕВОДІВ. Вуглеводи — обов'язкова складова їжі людини. Добова потреба організму дорослої людини у вуглеводах становить близько 400-500 г. У середньому на три чверті вона задовольняється за рахунок споживання крохмалю, решта — за рахунок фруктози, глюкози та сахарози. Незважаючи на те, що під час повного розщеплення 1 г глюкози виділяється вдвічі менше енергії, ніж під час розщеплення 1 г жирів, частка вуглеводів у забезпеченні організму людини і тварин енергією є найбільшою. Тому вуглеводи є цінними компонентами харчування людини і травоїдних та всеїдних тварин. Борошно, хліб, картопля, крупи належать до основних джерел вуглеводів у нашому харчуванні.
Групи харчових продуктів відповідно до вмісту вуглеводів
Назва групи
|
Вміст вуглеводів, %
|
Приклади харчових продуктів
|
Продукти з дуже високим вмістом вуглеводів
|
65 %
|
Кондитерські вироби, цукор, випічка, фініки, родзинки, макаронні вироби, манна крупа, варення, мед, джем, мармелад
|
Продукти з високим вмістом вуглеводів
|
40-60 %
|
Майже всі сорти хліба, бобові культури, халва, шоколад
|
Продукти з помірно високим вмістом вуглеводів
|
10-20 %
|
Картопля, буряк, деякі фрукти (виноград, яблука), фруктові соки
|
Продукти з низьким вмістом вуглеводів
|
до 10 %
|
Дині, кавуни, груші, персики, абрикоси, мандарини, апельсини, кабачки, гарбуз, морква, капуста
|
Продукти з незначним вмістом вуглеводів
|
до 5 %
|
Молочні продукти (кефір, сметана, сир, молоко), гриби, зелень, овочі та фрукти (помідори, листові овочі, лимони)
|
Целюлозу організм людини не перетравлює. У шлунку жуйних тварин, зайців, кролів завдяки наявності відповідних ферментів (біокаталізаторів) вона перетравлюється.
Вуглеводи застосовують у медицині. Зокрема, крохмаль є основним наповнювачем пігулок. Прочитайте анотацію до будь-яких ліків у вигляді пігулок і побачите, що вміст лікувальної речовини зазначається в міліграмах, тоді як крохмалю в ній у рази більше.
Крохмаль застосовують також у паперовій, текстильній, поліграфічній, косметичній та харчовій промисловості. Також з нього добувають глюкозу. Її використовують у виробництві етанолу для фармацевтичної та харчової промисловості.
Деревина, що на 50 і більше відсотків складається із целюлози, є джерелом теплової енергії, тому до цього часу її застосовують як паливо. Як матеріал її використовують для виготовлення різноманітних виробів з дерева.
Широке застосування має взаємодія целюлози з водою за наявністю каталізатора (реакція гідролізу). Її здійснюють у промислових масштабах з метою добування глюкози, з якої потім виробляють технічний етанол, що є сировиною у виробництві багатьох речовин, зокрема етену й каучуку.
Целюлозу застосовують у виробництві вибухівки, целулоїду, целофану, таких тканин, як ацетатний шовк, віскоза, штапель. Та найбільше целюлози використовує паперова промисловість. Наприклад, сторінки цього підручника виготовлено з офсетного паперу, обкладинку — з картону. Є ще папір газетний, пакувальний, фільтрувальний.

Застосування целюлози
ТЕМА: Застосування вуглеводів, їх
біологічна роль. Представлення
навчального проекту.
Параграф підручника № 36,37 повторити.
Підготуйте свій навчальний проект у вигляді презентації, яку надішліть за електронною адресою: narina0596@gmail.com. У розділі "Тема" зазначте "Проект 9 клас, своє прізвище та ім'я".
24.04.20.
Тема: Амінокислоти.
Параграф підручника № 38, с.218.
Є велика кількість органічних сполук, молекули яких містять, крім Карбону, Гідрогену й Оксигену, ще один елемент — Нітроген. Такі органічні сполуки називають нітрогеновмісними. До них належать аміни, амінокислоти і білки, а також низка фізіологічно активних речовин: вітаміни, антибіотики.
Склад і будова. Ви вже знаєте, що до складу рослинних і тваринних організмів уходять представники таких класів органічних сполук, як жири та вуглеводи. Не менш важливими для функціонування живих організмів є білки. Це високомолекулярні сполуки, утворені з ланок амінокислот.

Іван Якович ГОРБАЧЕВСЬКИЙ
(1854—1942)
Український учений, академік. Народився в Україні, працював у Відні, Празі, професор, ректор Українського вільного університету в Празі. Наукові праці стосуються органічної хімії та біохімії. Уперше синтезував сечову кислоту і з'ясував шляхи її утворення в організмі. Висловив думку про амінокислотний склад білків. Зробив внесок у розвиток української наукової термінології. Автор підручників з хімії українською мовою.
Думку про те, що амінокислоти є «цеглинками», з яких побудовані білки, уперше висловив видатний український біохімік і хімік І. Я. Горбачевський.
Амінокислот, як і інших органічних сполук, існує дуже багато. У живих організмах трапляється близько 700 амінокислот, але для синтезу білків рослин і тварин використовується лише 21 амінокислота, причому тільки α-амінокислоти.
У чому полягає відмінність амінокислот від карбонових кислот, що ви їх вивчали раніше? Карбонові кислоти містять крім вуглеводневої ще й карбоксильну групу —СООН, а амінокислоти — дві групи: карбоксильну та аміногрупу —NH2.
Якщо в молекулі етанової кислоти СН3СООН один атом Гідрогену у вуглеводневій групі замістити на аміногрупу, утвориться аміноетанова кислота:

Аміноетанова кислота — найпростіша з амінокислот. Серед них є такі, що містять дві карбоксильні групи або дві аміногрупи, гідроксильні та сульфуровмісні групи.

Модель молекули аміноетанової кислоти
Фізичні властивості. Амінокислоти — безбарвні кристалічні речовини з високими температурами плавлення, більшість із них добре розчинні у воді.
Утворення поліпептидів. Карбоксильна й аміногрупа протилежні за хімічним характером: перша є носієм кислотних властивостей, друга — основних. Отже, амінокислоти — амфотерні сполуки, вони реагують і з кислотами, і з лугами.

Найважливішою особливістю амінокислот є взаємодія молекул між собою. У реакцію вступають протилежні за функціями групи: карбоксильна група однієї молекули й аміногрупа іншої.

Унаслідок реакції можуть утворюватись ланцюги значної довжини — поліпептиди, або білки. Автором поліпептидної теорії є німецький учений Е. Фішер.

Фрагмент моделі поліпептидного ланцюга
Висновки
• Молекули амінокислот містять аміно- й карбоксильну групи.
• Амінокислоти належать до амфотерних сполук.
• Утворення поліпептидів — найважливіша хімічна властивість амінокислот.

Еміль Герман ФІШЕР
(1852—1919)
Німецький хімік, член Берлінської академії наук. Наукові праці присвячені хімії фізіологічно активних речовин. Синтезував низку вуглеводів, зокрема глюкозу і фруктозу. Встановив, що амінокислоти сполучаються між собою з утворенням поліпептидів, уперше добув дипептид. Лауреат Нобелівської премії 1902 р.
29.04.20.
ТЕМА: Білки. Біологічна роль
амінокислот і білків.
Параграф підручника № 38, виконати завдання №477, 479.
Полімерний поліпептидний ланцюг — основа молекули будь-якого білка.
Кожен білок має набір амінокислот, сполучених у певній, властивій тільки йому послідовності.
Як вам відомо, лише 20 амінокислот беруть участь у побудові білкових макромолекул, а кількість з'єднаних у різній послідовності амінокислотних залишків сягає 1018. Молекулярна маса деяких білків становить сотні мільйонів.
Будова білків дуже складна і зумовлюється не лише послідовністю амінокислотних залишків. Довгі ланцюги білкових молекул скручуються у спіралі, спіралі — у клубки, що певним чином розміщуються у просторі. Усе це в сукупності визначає особливості кожного білка зокрема. Через таку складність розшифрування структури природних білків — надзвичайно складне завдання.

Модель молекули білка гемоглобіну
За складом білки поділяють на протеїни — прості білки, що складаються тільки із залишків молекул амінокислот, і протеїди — складні білки, що складаються із залишків молекул амінокислот і різних небілкових складових, наприклад йонів металічних елементів (як Fe2+ у гемоглобіні) та різних органічних сполук.
Денатурація (від лат. denaturare — позбавлення природних якостей). Серед білків є розчинні у воді й такі, що утворюють колоїдні розчини. До перших належить білок курячого яйця. Саме з цим розчином зручно проводити досліди.
До білка курячого яйця у пробірці добавимо води, суміш розмішаємо. Переконаємося, що утворився прозорий розчин. Нагріємо розчин білка і спостерігатимемо, як він зсідається, або денатурує.
Саме цей процес денатурації має місце під час кулінарної обробки білкових харчових продуктів — м'яса, яєць, риби.
З хімічного боку, денатурація — це руйнування складної просторової структури білка (послідовність амінокислотних залишків при цьому не порушується). Саме тому, наприклад, висока температура небезпечна для організму людини. При цьому білки втрачають біологічну активність, живі клітини гинуть. Те саме відбувається і під дією сильних кислот і лугів. У разі потрапляння їх на шкіру може статися хімічний опік. Денатурацію білка спричиняє також тривала дія алкоголю (етанолу).

Схема денатурації білка
Білки можуть розкладатися під дією мікроорганізмів. У результаті утворюються не амінокислоти, а амоніак, сірководень, інші речовини з неприємним запахом. Його поява свідчить про те, що відбувається процес розкладу (гниття) білка. Пригадайте, який неприємний запах мають протухле яйце, зіпсовані м'ясо чи риба. Заморожування продуктів, маринування, копчення знижують активність мікроорганізмів або навіть знищують їх, процес розкладу уповільнюється, і продукти зберігаються значно довше.
Біологічне значення білків. Білки їжі безпосередньо не засвоюються організмом, спершу вони розщеплюються до амінокислот під дією речовин, що містяться у травному тракті, потім амінокислоти всмоктуються у кров, а вже нею переносяться до печінки, де організм синтезує білки, характерні саме для нього.
Білки є основним будівельним матеріалом тваринних організмів, а саме його клітин. М'язи, гемоглобін крові, волосся, шкіра, ферменти мають білкову природу.
Запас амінокислот, необхідний для нормального функціонування, має поповнюватись в організмі людини за рахунок білків їжі .

Співвідношення поживних речовин у збалансованому харчуванні
Це особливо важливо для молодого організму, який росте і розвивається. Тому їжа молодої людини має містити достатню кількість білків. Найбагатші на білки м'ясо, риба, молоко, сир, яйця, бобові, горіхи.
Деякі види мікроорганізмів здатні використовувати вуглеводні як поживне середовище і виробляти на його основі білкову масу. На цій властивості мікроорганізмів ґрунтується мікробіологічний синтез. Наприклад, у такий спосіб можна добути білкову масу з вуглеводнів нафти, природного газу чи відходів переробки деревини і використовувати її для відгодівлі сільськогосподарських тварин.
Біологічне значення амінокислот. До складу білків входять 20 амінокислот, причому 10 з них належать до незамінних. Їх назва пов'язана з тим, що тваринні організми, на відміну від рослинних, не здатні самостійно синтезувати амінокислоти. Отже, необхідні для життєдіяльності амінокислоти мають надходити в готовому вигляді, у складі їжі. Нестача амінокислот може спричинити хворобу, тому виснаженим людям амінокислоти, як ліки, вводять прямо у кров.
06.05.20.
ТЕМА: Представлення результатів
навчальних проектів
1) Значення природних і синтетичних органічних сполук.
2) Захист довкілля від стійних органічних забрудників.
3) Друге життя паперу
4) Джерела органічного забруднення території громади (мікрорайону).
Підготувати навчальний проект у вигляді електронної презентації чи роботі на А3 (малюнки + інформація). Надіслати фото роботи або презентацію за електронною адресою narina0596@gmail.com.
08.05.20.
ТЕМА: Практична робота №5
"Виявлення органічних сполук у харчових продуктах"
Оформлювати практичну роботу необхідно так само як і попередню(з фото, яке розміщене нижче вам необхідно переписати тему, мету та реактиви). Таблиця, яку необхідно заповнити та яким чином оформлювати висновки ви можете спостерігати на відео.
Виконану практичну роботу сфотографувати та надіслати за електронною адресою narina0596@gmail.com. У розділі ТЕМА будь ласка зазначте "9 клас практична №5 своє прізвище ім'я".
13.05.20.
ТЕМА: Контрольна робота з теми
"Органічні речовини"
15.05.20.
ТЕМА: Багатоманітність речовин та
хімічних реакцій. Взаємозв'язки між
речовинами та їхні взаємоперетворення.
Класифікація речовин. Ви знаєте, що речовини поділяють на прості та складні. Кожна проста речовина утворена одним хімічним елементом, а складна речовина (або хімічна сполука) — щонайменше двома елементами.

За низкою характерних властивостей серед простих речовин розрізняють метали і неметали. Існують також прості речовини, які за одними властивостями нагадують метали, а за іншими — неметали.
Складні речовини поділяють на неорганічні та органічні (сполуки Карбону).
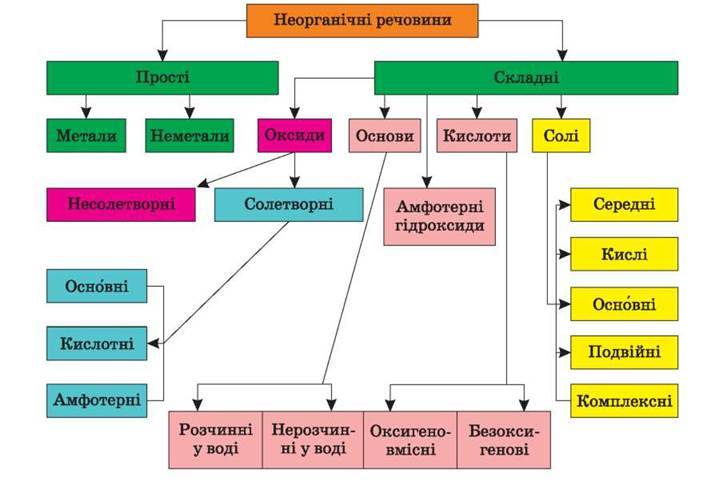

Будова речовин. Вам відомо, що прості речовини складаються з атомів або молекул. Атомну будову мають графіт, алмаз, силіцій, інертні гази, метали, а молекулярну — водень, кисень, озон, білий фосфор, сірка тощо.
Будова складних речовин різноманітніша. Основні та амфотерні оксиди, основи та солі є йонними речовинами, кислотні оксиди і кислоти складаються з молекул, а сполуки металічних елементів з Карбоном, Нітрогеном, Фосфором — з атомів або йонів.
Більшість органічних речовин має молекулярну будову, а солі карбонових кислот, деякі нітрогеновмісні сполуки містять йони.
Існують речовини (серед них — червоний фосфор, поліетилен, целюлоза, білки), молекули яких побудовані з багатьох тисяч однакових атомів або груп різних атомів, сполучених між собою ковалентним зв'язком. Це — високомолекулярні речовини. Якщо групи атомів у таких молекулах мають однакову будову (як, наприклад, у поліетилені), то сполуку називають полімером.
Хімічний зв'язок у речовинах. Будову речовини визначає тип хімічного зв'язку, який реалізується в ній.
Хімічний зв'язок у речовинах

Йонний зв'язок утворюється між протилежно зарядженими йонами внаслідок їхньої електростатичної взаємодії (взаємного притягання). Він існує в основних і амфотерних оксидах, основах, солях.
Ковалентний зв'язок виникає між атомами під час утворення спільних електронних пар. Зв'язок цього типу наявний у будь-якій молекулі, а також у складних йонах (OH-, CO2-3, PO3-4, СН3СОО- тощо).
Ковалентний зв'язок буває полярним і неполярним. Полярний зв'язок реалізується між атомами елементів із різною електронегативністю, а неполярний — між однаковими атомами або атомами елементів з однаковою електронегативністю.
У металах реалізується металічний зв'язок. Він зумовлений наявністю в них електронів, здатних вільно рухатися в усьому об'ємі речовини.
Класифікація хімічних реакцій. Майже всі речовини можуть зазнавати хімічних перетворень, які залежать від природи речовин, зовнішніх умов, інших чинників.
Вам відомо, що хімічні реакції розрізняють:
- за кількістю та складом реагентів і продуктів (реакції сполучення, заміщення, розкладу, обміну);
- за тепловим ефектом (екзотермічні та ендотермічні реакції);
- за напрямом перебігу (оборотні й необоротні реакції).
Крім того, виокремлюють окисно-відновні реакції (в таких перетвореннях елементи, наявні в реагентах, змінюють ступені окиснення), каталітичні реакції (у них використовують каталізатори), реакції полімеризації тощо.
Ви знаєте, що зв'язки між речовинами, які походять від одного елемента, називають генетичними зв'язками. Їх використовують у хімічній технології, зокрема при переробці металічних руд, виробництві кислот. При добуванні сульфатної кислоти із природної сірки просту речовину спочатку спалюють, після чого здійснюють реакцію сульфур(IV) оксиду з киснем, а потім — реакцію сульфур(VI) оксиду з водою. Відповідна схема послідовних перетворень речовин:
S → SO2 → SO3 → H2SO4.
Для того щоб добути основу або кислоту з оксиду, який не взаємодіє з водою, здійснюють такі перетворення:
оксид → сіль → основа (кислота).
20.05.20.
ТЕМА: Місце хімії серез наук
про природу,
її значення для розуміння наукової картини
світу.
Параграф №40,41.
Представлення результатів навчальних проектів:
1) Екологічна ситуація в моїй місцевості.
2) Видатні вітчизняні хіміки як учені й особистості.
Надіслати фото роботи або презентацію за електронною адресою narina0596@gmail.com.
Хімія та інші природничі науки. Ви знаєте, що хімія — наука про речовини, їхню будову, властивості й перетворення. Хіміки вивчають природні речовини, а також добувають речовини, яких у природі немає, досліджують їх і визначають перспективи використання в тій чи іншій галузі.
Хімія — природнича наука. Про її зв'язки з біологією, фізикою, геологією, іншими природничими науками (схема 6) ви дізналися в 7 класі. Вам відомо, що біологи досліджують живі організми, а в них щомиті відбуваються хімічні реакції за участю органічних і неорганічних речовин. Геологи ведуть пошук корисних копалин, нових мінералів; їм необхідно знати, за яких умов у земній корі можуть утворюватися різні речовини.
Зв'язки хімії з іншими природничими науками


Хімія тісно пов'язана з екологією — наукою про взаємозв'язки живих організмів між собою та з довкіллям, їх вплив одне на одного. Хіміки визначають ступінь речовинного забруднення навколишнього середовища в різних регіонах, складають разом з екологами відповідні прогнози на майбутнє. Вони розробляють методи знешкодження небезпечних речовин промислового походження й видалення їх із промислових стоків і газових викидів.
Медики спрямовують свої зусилля на подолання поширених хвороб, епідемій, а це неможливо зробити без нових фармацевтичних препаратів, добутих і досліджених хіміками.
За останні півтора століття на стику хімії та інших природничих наук виникли нові науки — фізична хімія, біохімія, геохімія, космохімія, фармацевтична хімія, екологічна хімія, які розвиваються швидкими темпами.
22.05.20
.
ТЕМА: Роль хімічної науки для
забезпечення сталого розвитку людства.
Хімічна наука і виробництво в Україні.
Параграф №42,43.
Наше життя важко уявити без використання досягнень хімічної науки. Ми є свідками того, що численні полімери і пластмаси дедалі більше замінюють традиційні природні речовини і матеріали. Розвиток сучасної техніки, енергетики, зв'язку, транспорту, аерокосмічної галузі зобов'язаний застосуванню нових сполук, сплавів, створенню ефективних матеріалів з особливими механічними, фізичними та іншими властивостями.
Хімічні заводи випускають мільйони тонн мінеральних добрив (мал. 102), різноманітні засоби захисту сільськогосподарських рослин від шкідників і хвороб. Це сприяє розвитку землеробства і тваринництва, допомагає розв'язувати проблему дефіциту харчових продуктів у деяких регіонах планети.

Мал. 102. Зразки мінеральних добрив
Оскільки рослини є невичерпною органічною сировиною, необхідно розробляти і впроваджувати технології з переробки рослинних залишків на біогаз, біопаливо, біопальне (мал. 103). Це буде вагомим внеском у розв'язання енергетичної проблеми у світі.

Мал. 103. Цистерни з рідким біопальним
Харчова промисловість також використовує досягнення хімії. Харчові добавки поліпшують смак продуктів, емульгатори підтримують їх необхідну консистенцію, консерванти дають змогу значно збільшити термін придатності. Безперечно, всі ці речовини мають бути безпечними для людини.
Швидкими темпами розвивається виробництво хімічних товарів для побуту. У торговельній мережі покупцям пропонують ефективні мийні засоби, клеї, герметики, лаки, фарби тощо. Використання сучасних засобів побутової хімії значною мірою допомагає в домашньому господарстві, дає змогу людині приділити більше часу своїй професійній та іншій діяльності.
Важко визначити кількість наявних косметичних засобів. Багато речовин, добутих у хімічних лабораторіях, є складниками кремів, гелів, лосьйонів; вони позитивно впливають на шкіру, волосся, лікують і відновлюють їх.
Роль хіміків дуже важлива у сфері розроблення ефективних маловідходних технологій (мал. 104), схем повторного використання води в промисловості, утилізації промислових і побутових відходів.

Мал. 104. Сучасний хімічний завод
За обсягом виробництва хімічна промисловість посідає провідне місце в економіці нашої країни. Вона охоплює виробництво мінеральних добрив, соди, лугів, кислот, інших неорганічних і органічних речовин, полімерів та матеріалів на їх основі (гуми, пластмас), синтетичних смол, хімічних волокон, скла, цементу, переробку нафти.
Багато видів вітчизняної хімічної продукції йде на експорт.
Хімія і сприйняття навколишнього світу. Хімічні знання допомагають краще зрозуміти наукову картину світу. У космічному просторі за умов високого вакууму та екстремальних температур існують лише окремі атоми, йони, молекули, а на планетах, їхніх супутниках, кометах — деякі прості й складні речовини. Умови Землі (помірні температура й атмосферний тиск), енергія Сонця сприяють утворенню різноманітних неорганічних і органічних сполук, існуванню живих організмів на планеті.
Багато змін у природі Землі пов'язані з колообігом елементів і речовин, накопиченням їх в одних регіонах і перенесенням в інші. Знаючи про ці процеси, можна пояснити, наприклад, утворення різних корисних копалин, вапнякових печер, пустель, наявність у природній воді певних розчинених солей.
Цікаво знати
5 червня — Всесвітній день охорони довкілля.
Хімічні знання є складником загальної культури людини, полегшують її повсякденну діяльність і побут, допомагають зрозуміти, як побудований навколишній світ, яка роль у ньому речовин і хімічних реакцій. Використовуючи ці знання, ми зможемо запобігти забрудненню природи і зберегти її для наступних поколінь.












