У робочих зошитах записуємо дату, тему уроку.
Все, що виділено червоним кольором необхідно записати. Малюнки та таблиці за необхідності записати (це буде вказано). (нові конспекти розміщені нижче)
З 24.05.20. результати проектів, практичних робіт, тести, розв'язок задач НЕ ПРИЙМАЮТЬСЯ.
У робочих зошитах записуємо дату, тему уроку.
Все, що виділено червоним кольором необхідно записати. Малюнки та таблиці за необхідності записати (це буде вказано). (нові конспекти розміщені нижче)
З 24.05.20. результати проектів, практичних робіт, тести, розв'язок задач НЕ ПРИЙМАЮТЬСЯ.
19.03.20
19.03.20
ТЕМА: Розчин і його компоненти: розчинник, розчинена речовина.
Записати все, що блакитного кольору!
Речовина, що розчиняється, дістала назву розчинена речовина. Речовина, в якій розчиняють — розчинник, а утворена суміш — розчин (мал). Підсолоджена цукром вода є прикладом розчину, в якому цукор — розчинена речовина, вода — розчинник.
У розчині частинки розчиненої речовини рівномірно розподіляються між молекулами води, розчини можуть складатись із двох чи більше розчинених речовин. Вода — найкращий розчинник у природі. Молекула води, як магніт, має два полюси: негативний, сконцентрований на атомі Оксигену, і позитивний, сконцентрований на атомах Гідрогену. Між молекулами води утворюються специфічні хімічні зв’язки — водневі. Це досить слабкі зв’язки, але їх дуже багато. Вона здатна розчиняти багато твердих, рідких і газоподібних речовин. Вода — універсальний розчинник: розчиняє гази, рідини, тверді речовини.
Розчиняються у воді і гази, наприклад кисень, азот, вуглекислий газ. В тому, що у воді розчиняються гази повітря, легко переконатися, якщо налити в стакан холодної води і поставити його на стіл у кімнаті. Через деякий час на внутрішніх стінках з’являться бульбашки газів. Ще краще це спостерігати, коли налити в стакан газованої води. Газована вода — розчин вуглекислого газу у воді. У пляшці з мінеральною водою, наприклад вуглекислий газ розчинений при підвищеному тиску. Коли відкривають пробку, тиск у пляшці зменшується, і газ бурхливо виділяється, захоплюючи з собою воду у вигляді піни. Наведемо приклади різних розчинів: газовані мінеральні води, наприклад «Оболонська», «Миргородська» та багато інших, готують, розчиняючи вуглекислий газ у воді з мінеральних джерел; добре відомий столовий оцет готують з оцтової хислоти (це рідина) та води; цукор, сіль, питна сода (тверді речовини, розчинні у воді). Розчинність газів зростає із зниженням температури і з підвищенням тиску.
Записати все, що блакитного кольору!
Речовина, що розчиняється, дістала назву розчинена речовина. Речовина, в якій розчиняють — розчинник, а утворена суміш — розчин (мал). Підсолоджена цукром вода є прикладом розчину, в якому цукор — розчинена речовина, вода — розчинник.
Речовини, з яких утворений розчин, є його компонентами, серед яких розрізняють розчинник і розчинену речовину. Запишіть схему, класифікація розчинів:
Розчинником прийнято називати компонент розчину, вміст якого більший, і який має з розчином однаковий агрегатний стан (виняток - вода. Вона завжди є розчинником, навіть, якщо її набагато менше).
Наприклад:
Вода (розчинник) + мідний купорос(розчинена речовина) = розчин.
У розчині частинки розчиненої речовини рівномірно розподіляються між молекулами води, розчини можуть складатись із двох чи більше розчинених речовин. Вода — найкращий розчинник у природі. Молекула води, як магніт, має два полюси: негативний, сконцентрований на атомі Оксигену, і позитивний, сконцентрований на атомах Гідрогену. Між молекулами води утворюються специфічні хімічні зв’язки — водневі. Це досить слабкі зв’язки, але їх дуже багато. Вона здатна розчиняти багато твердих, рідких і газоподібних речовин. Вода — універсальний розчинник: розчиняє гази, рідини, тверді речовини.
Розчинення — це складний фізико-хімічний процес, при якому відбувається взаємодія між частинками розчинника і розчиненої речовини.
Ви знаєте, що молекули речовин перебувають у безперервному русі. Цим пояснюється явище дифузії — поширення одних речовин в інші. Наприклад, покладемо в циліндр з водою кристали мідного купоросу. Через деякий час навколо кристалів вода забарвиться в голубий колір. Невидимі частинки мідного купоросу під впливом молекул води відірвалися від кристалів і дифундували у воду. Дифузія відбувається повільно, але зрештою утвориться - однорідний розчин.
Процес розчинення можна прискорити, якщо взяти тверду речовину не у великих кристалах, а в дрібному порошку. Подрібнивши речовину, ми збільшили поверхню стикання її з рідиною, речовина розчиняється швидше. Можна прискорити розчинення речовини, перемішуючи рідину або нагріваючи її, а також помістивши речовину на поверхні розчинника. Густина розчину більша за густину води, тому, утворившись біля кристалів, покладених у мішечок, розчин струминками падає вниз, і розчинення прискорюється.
Розчин не відстоюється, він завжди однорідний.
Нерозчинні у воді речовини (наприклад, крейда, глина) при змішуванні з нею лишаються деякий час у завислому стані, утворюючи каламутну рідину, але згодом завислі частинки осідають на дно посудини.
З курсу природознавства ви знаєте, що розчинність більшості речовин не безмежна. Наприклад, при температурі 20 °С у воді об’ємом 1 л може розчинитися цукор масою 2000 г, хлорид натрію масою 359 г, сульфат міді масою 207 г, сульфат кальцію масою 1 г.
Розчин, у якому дана речовина при даній температурі більше не розчиняється, називається насиченим, а розчин, у якому ще може розчинятися ця речовина — ненасиченим. Ненасичені розчини умовно поділяють на концентровані – з високим вмістом розчиненої речовини, і розведені – з низьким вмістом розчиненої речовини.
Розчинність речовини показує, яка маса її може розчинитися в певному об’ємі води при даній температурі, щоб розчин став насиченим.
Розчинна речовина чи ні, ви можете побачити у таблиці розчинності речовин. Вона є на форзаці вашого підручника з хімії. Н - нерозчинна речовина, М - малорозчинна, Р - розчинна.
Розчиняються у воді і гази, наприклад кисень, азот, вуглекислий газ. В тому, що у воді розчиняються гази повітря, легко переконатися, якщо налити в стакан холодної води і поставити його на стіл у кімнаті. Через деякий час на внутрішніх стінках з’являться бульбашки газів. Ще краще це спостерігати, коли налити в стакан газованої води. Газована вода — розчин вуглекислого газу у воді. У пляшці з мінеральною водою, наприклад вуглекислий газ розчинений при підвищеному тиску. Коли відкривають пробку, тиск у пляшці зменшується, і газ бурхливо виділяється, захоплюючи з собою воду у вигляді піни. Наведемо приклади різних розчинів: газовані мінеральні води, наприклад «Оболонська», «Миргородська» та багато інших, готують, розчиняючи вуглекислий газ у воді з мінеральних джерел; добре відомий столовий оцет готують з оцтової хислоти (це рідина) та води; цукор, сіль, питна сода (тверді речовини, розчинні у воді). Розчинність газів зростає із зниженням температури і з підвищенням тиску.
Розчиняються у воді і гази, наприклад кисень, азот, вуглекислий газ. В тому, що у воді розчиняються гази повітря, легко переконатися, якщо налити в стакан холодної води і поставити його на стіл у кімнаті. Через деякий час на внутрішніх стінках з’являться бульбашки газів. Ще краще це спостерігати, коли налити в стакан газованої води. Газована вода — розчин вуглекислого газу у воді. У пляшці з мінеральною водою, наприклад вуглекислий газ розчинений при підвищеному тиску. Коли відкривають пробку, тиск у пляшці зменшується, і газ бурхливо виділяється, захоплюючи з собою воду у вигляді піни. Наведемо приклади різних розчинів: газовані мінеральні води, наприклад «Оболонська», «Миргородська» та багато інших, готують, розчиняючи вуглекислий газ у воді з мінеральних джерел; добре відомий столовий оцет готують з оцтової хислоти (це рідина) та води; цукор, сіль, питна сода (тверді речовини, розчинні у воді). Розчинність газів зростає із зниженням температури і з підвищенням тиску.
13.03.20
13.03.20
Тема: Вода, склад и молекули, поширеність у природі, фізичні властивості. Вода — розчинник.
Параграф підручника №25, завдання №186,187.
Запишіть: Вода
— складна речовина, утворена двома елементами — Гідрогеном і Оксигеном. Її
хімічна формула — Н2О. Вода належить до оксидів. Це
молекулярна речовина. Графічна формула молекули води:
Фізичні властивості. Запишіть:
Вода,
Н2O – хімічна речовина у вигляді прозорої безбарвної рідини без
запаху і смаку. У природі існує у трьох агрегатних станах: у твердому (лід), рідкому (вода) і газоподібному
(водяна пара).
Загальновідомо,
що чиста вода – безбарвна рідина без запаху і смаку, яка замерзає при температурі
0 °С, а закипає при100 °С (за тиску 760 мм рт. ст.) (запис у зошит). Вона має густину
1,00 г/см3 (при 4 °С), малу теплопровідність, не проводить електричного струму.
Воду
в твердому стані називають льодом, а в газуватому стані – водяною парою. Лід
трохи легший за воду; його густина становить 0,917 г/см3, тобто густина льоду
менша, за густину води. Це можна пояснити тим, що між молекулами Н2О у льоді
існують порожнини. При таненні вони зникають, і речовина «ущільнюється». Тому
лід у воді не тоне, а знаходиться на її поверхні.
2. Розклад води.
Вода – термічно стійка
речовина. Її молекули починають руйнуватися за дуже високої температури
приблизно 2500 градусів. Воду можна також розкласти за
дії на неї постійного електричного струму (запис у зошит).
3. Поширення у природі
Вода — одна із найпоширеніших
речовин на нашій планеті.
Річки, озера, моря, джерела,
колодязі, калюжі, роса, дощ, туман, хмари, лід, сніг, град, іній. Все це холодна
вода в природі. А от цікаво, чи існує така гаряча вода в природі, щоб вона
нагрівалася сама, без допомоги людини? Так, це гейзери.
Вода вкриває понад 2/3
поверхні Землі.(запис у зошит). Вона здійснює у природі постійний кругообіг,
випаровуючись з поверхні й повертаючись на неї у вигляді опадів.
Приблизно
97 % усієї води знаходиться в морях і океанах. На прісну воду припадає менше 3
%; майже вся вона сконцентрована у снігах і льодах Антарктиди, Арктики, територіях
із «вічною мерзлотою».
У
живих організмах масова частка води становить від 50 до 99 %. В організмі
дорослої людини її приблизно 65 % за масою (запис у зошит).
Чистої
води в природі не існує. Контактуючи з повітрям, вода розчиняє невеликі кількості
його компонентів — кисню, азоту, вуглекислого газу. У ній містяться ще й часточки
пилу, інші розчинні та нерозчинні домішки.
Оскільки
вода має здатність розчиняти у собі інші речовини, то давайте докладніше
поговоримо про розчини, які вона утворює.
4. Вода-розчинник
Вам уже відомо, що суміші речовин бувають однорідними й неоднорідними. Однорідні суміші відрізняються
від неоднорідних тим, що в них рівномірно розподілені найдрібніші частинки
речовин (наприклад, молекули). Однорідні суміші речовин називають розчинами (запис у зошит).
Багато
хто із вас, мабуть, думає, що розчин – це завжди рідина. Однак існують не лише
рідкі розчини, а й тверді та газуваті.
Розчин
містить щонайменше дві речовини. Це – його компоненти. Один із них називають
розчинником, інші – розчиненими речовинами (запис у зошит).
Якщо
агрегатний стан усіх речовин, які утворили розчин, однаковий, то розчинником вважають
речовину, маса якої найбільша. Щодо водних розчинів існує традиція завжди називати
розчинником воду, навіть якщо її менше, ніж розчиненої речовини.
При
змішуванні води з іншими речовинами часто утворюються розчини. Такі тверді
речовини як кухонна сіль, цукор, лимонна кислота розчиняються у воді, а крейда,
скло, золото в ній нерозчинні. Рідини і гази також мають різну розчинність у
воді. Олія, бензин у воді не розчиняються, а етиловий спирт, гліцерин
змішуються з водою в будь-яких співвідношеннях, утворюючи розчини, тобто
необмежено розчиняються в ній.
Воду
як розчинник використовують у різних галузях промисловості, техніці, сільському
господарстві, будівництві, медицині. Без водних розчинів ми не можемо обійтися
в повсякденному житті.
Вода
виконує роль розчинника і в природі. У морській і океанській воді серед
розчинених речовин переважає сіль — натрій хлорид NaCl, а в прісній — інші
сполуки.

ЗАПАМ'ЯТАЙТЕ Густина води = 1 г/мл
Задача №1
Якщо в умові задачі сказано, що додали до розчину розчинену речовину, то змінюється маса всього розчину №2 та маса розчиненої речовини №2, тобто при знаходженні масової частки розчину №2, вам необхідно знайти масу р-ну №2 та масу р.р. №2.
Задача №3
Домашнє завдання:
Розглянемо, що необхідно робити, чим користуватися, щоб виготовити розчин з певною масовою часткою розчиненої речовини.
Більшість оксидів здатні вступати в хімічні реакції з водою. Зазвичай ці реакції є реакціями сполучення, у результаті яких утворюються продукти приєднання води до оксидів. Речовини, що утворюються сполученням води з іншими речовинами, називають гідратами.


Домашня робота:
4) Напишіть формули оксидів, що відповідають таким гідратам: H3PO4, Ca(OH)2, Fe(OH)3, H2SO4, Fe(OH)2, HNO3, H2SiO3.
02.04.20.
ТЕМА: Кількісний склад розчину. Масова
частка розчиненої речовини.
Усі формули необхідно записати у ваш зошит, оскільки потім вони будуть вам необхідні для проведення розрахунків!
Пригадайте формулу для обчислення масової
частки елемента у складній речовині:

n – кількість атомів хімічного
елемента (індекс);
Ar(елемента) – відносна
атомна маса елемента;
Mr(речовини) – відносна молекулярна маса речовини (для
речовин немолекулярної будови – відносна формульна маса).
w Масова частка (дубль
– ве) є безрозмірною величиною або згідно наведених формул може вимірюватися у
%.
Спробуйте по аналогії вивести формулу для
обчислення масової частки розчиненої речовини у розчині:
m(речовини) – маса розчиненої речовини, вимірюється
в г або кг;
m(розчину) – маса розчину
в г або кг.
Оскільки розчин
складається з розчиненої речовини і води, то
m(розчину) = m(речовини) + m(розчинника, наприклад води)
Приклади задач (не записуємо, тільки звертаємо увагу на алгоритм розв'язку):
Задача №1
Обчисліть масову
частку цукру в розчині, що складається з 200г води (склянка) та 50г цукру (5
чайних ложок з гіркою).
Задача №2
У медицині часто
використовують фізіологічний розчин – водний розчин NaCl (кухонної солі) з
постійною масовою часткою солі . Стерильний фізрозчин використовують для
внутрішньом`язових та внутрішньовенних ін’єкцій, а також для
інгаляцій. Обчисліть масову частку натрій хлориду у фізрозчині, якщо для його
приготування в лабораторії беруть 9,1кг солі та 1000кг води.
Задача №3
Щоб приготувати помадку для прикрашання тортів, тістечок готують
цукровий сироп з додаванням кількох крапель лимонного соку. Обчисліть скільки
цукру та води потрібно для приготування сиропу масою 400г, якщо масова частка
цукру в ньому 0,625.
Домашнє завдання вирішити задачі:
- Які маси розчиненої речовини та води містяться в 60 г розчину з масовою часткою речовини 0,05?
- У 300 г розчину міститься 30 г NaOH (натрій гідроксиду). Визначте масову частку натрій гідроксиду в розчині.
- Які маса калій хлориду (KCl) міститься у 15 г розчину з масовою часткою калій хлориду 5%?
03.04.20.
ТЕМА: Кількісний склад розчину. Масова
частка розчиненої речовини.
Під час роботи з розчинами важливо знати їхній кількісний склад, зокрема масову частку розчиненої речовини. Цю важливу кількісну характеристику завжди зазначають на етикетках хімічних реактивів, харчових продуктів, лікарських засобів у формі розчинів. Наприклад, масова частка брильянтового зеленого в його спиртовому розчині становить 1 %; масова частка амоніаку в його водному розчині - 10 %; масова частка оцтової кислоти у столовому оцті – 6 %, а масова частка гідроген пероксиду в його водному розчині - 3 % (виразіть ці масові частки у частках від одиниці).
Якщо препарат призначений для лікування дітей, то масова частка розчиненої речовини в ньому зазвичай у кілька разів менша, ніж у ліках для дорослих.
Запам'ятайте! Важливо уважно читати етикетки на споживчих товарах, аби не сплутати, наприклад, столовий оцет, масова частка оцтової кислоти в якому не перевищує 9 %, з оцтовою есенцією. Масова частка оцтової кислоти в ній становить 70 %. Помилкове вживання есенції замість столового оцту може спричинити важкі хімічні опіки органів травлення.
Для рішення задач вам знадобиться ще одна формула та два наслідки з неї. Запишіть формулу для знаходження густини (ро):
ЗАПАМ'ЯТАЙТЕ Густина води = 1 г/мл
Задача №1
Визначити маси розчинів з масовими частками розчинів
10% і 30% необхідних для приготування 300 г розчину з массовою часткою 15%.
Задача №2
До
300 г
20%-го розчину купрум хлориду додали 200 мл води. Обчислити масову частку солі
у новоутвореному розчині.
Алгоритм розв'язку задачі такого типу:
- Оскільки вода зазначена в мл, то необхідно об'єм перевести в масу, для цього використовуємо значення густини.
- Оскільки до розчину додається вода, то змінюється загальна маса всього розчину, а маса розчиненої речовини, в випадку задачі купрум хлориду, не змінюється. Знаходимо масу розчиненої речовини, щоб потім її використати у кінцевих розрахунках.
- Знаходимо масу розчину №2. До розчину №1 було додано воду, значить маса розчину №2 більша рівно на стільки, скільки було додано води, тобто 200 мл = 200 г.
- Підставляємо наші дані у формулу для знаходження масової частки розчиненої речовини у розчині №2.
Якщо в умові задачі сказано, що додали до розчину розчинену речовину, то змінюється маса всього розчину №2 та маса розчиненої речовини №2, тобто при знаходженні масової частки розчину №2, вам необхідно знайти масу р-ну №2 та масу р.р. №2.
Задача №3
100г розчину, де солі 5% змішали з 70г розчину, де солі
10%. Визначіть масову частку солі в новоутвореному розчині.
Дано:
m1(р-ну)=100г
w1(солі)=5%=0,05
m2(р-ну)=70г
w2(солі)=10%=0,1
Знайти:
w3(солі)-?
Розв’язок
1.
Визначаємо масу солі в першому розчині:
m1(солі)= w1(солі)* m1(р-ну);
m1(солі)= 100г*0,05=5г;
2. Визначаємо масу солі в другому розчині:
m2(солі)=
w2(солі)* m2(р-ну);
m2(солі)= 70г*0,1=7г;
3.
Визначаємо масу третього розчину:
m3(р-ну)= m1(р-ну)+ m2(р-ну)=100г+70г=170г;
4.
Визначаємо масу розчиненої речовини в третьому розчині:
m3(солі)= m1(солі)+ m2(солі)=5г+7г=12г;
5. Визначаємо масову частку
розчиненої речовини в третьому розчині:
w3(солі)= m3(солі)/m3(р-ну);
Відповідь: масова частка солі в
новоутвореному розчині становить 7%.
Домашнє завдання:
- До 150 г 20%-го розчину кислоти додали 60г води. Визначте масову частку розчиненої речовини в новому розчині.
- Яку масу води слід додати до 300 г розчину з масовою часткою кислоти 16%, щоб добути розчин із масовою часткою 10%.
09.04.20.
ТЕМА: Виготовлення розчинів.
Розглянемо, що необхідно робити, чим користуватися, щоб виготовити розчин з певною масовою часткою розчиненої речовини.
ЩО ПОТРІБНО ДЛЯ ВИГОТОВЛЕННЯ РОЗЧИНУ.
Незалежно від того, які розчини виготовляють, використовують тільки чисті розчинники. Заздалегідь готують посуд і необхідне обладнання для приготування розчину, а також посуд для його зберігання. Ви напевне звернули увагу, що в хімічному кабінеті розчини зберігаються у скляних ємкостях, на яких обов’язково є етикетка із зазначенням вмісту розчиненої речовини.
У хімічних лабораторіях для приготування розчинів використовують посуд, виготовлений із матеріалів, які не вступають у реакцію з компонентами розчину. Найчастіше цим матеріалом є скло. Посуд для зберігання розчинів обов’язково повинен бути закритий спеціально підібраними кришками чи пробками, щоб у нього не потрапляли пил і повітря, з окремими компонентами яких розчин може прореагувати
Для виготовлення розчину з необхідною масовою часткою розчиненої речовини потрібні: речовина для розчинення, розчинник, посудина для виготовлення розчину, скляна паличка чи ложечка для помішування, терези, різноважки, мірний посуд.
Виготовлення розчину з певною масовою часткою розчиненої речовини. Перед виготовленням розчину здійснюють обчислення маси розчинної речовини та об’єму розчинника.
Алгоритм дій для виготовлення розчину
1. Зважити розчинену речовину.
2. Перенести її у колбу (стакан).
3. Відміряти необхідний об’єм розчинника — води.
4. Добавити воду до розчиненої речовини.
5. Перемішати компоненти до утворення гомогенного (однорідного) розчину.
Щоб перевірити наскільки добре ві запам'ятали послідовність дій, виконайте вправу перейшовши за посиланням: https://learningapps.org/watch?v=p1d5yfcr319
Трапилось на моїй кухні таке
диво.
Давайте спробуємо це перевірити!
Для цього необхідно приготувати три розчини з різмою масовою часткою солі: 10%, 20%, 30%.
Дослід 1.
Виготовити розчин масою 150 грамів з масовою часткою
кухонної солі 10 %.
Дано:
W (кухонної солі) = 10
% m(кухонної солі)= 150 * 0,1 = 15
m (розчину) = 150 г m (Н2О) =
150 – 15 = 135
m (кухонної солі) =? V = 135 / 1 = 135 мл
m (Н2О) =?
Дослід 2.
Виготовити розчин масою 150 грамів з масовою часткою
кухонної солі 20 %.
Дано:
W (кухонної солі) = 20
% m(кухонної солі)= 150 * 0,2 = 30
m (розчину) = 150 г m (Н2О) =
150 – 30 = 120
m (кухонної солі) =? V = 120 / 1 = 120 мл
m (Н2О) =?
Дослід 3.
Виготовити розчин масою 150 грамів з масовою часткою
кухонної солі 30 %.
Дано:
W (кухонної солі) = 30
% m(кухонної солі)= 150 * 0,3 = 45
m (розчину) = 150 г m (Н2О) =
150 – 45 = 105
m (кухонної солі) =? V = 105 / 1 = 105 мл
m (Н2О) =?
Давайте порівняємо результати:
Контрольний зразок – яйце в склянці з дистильованою водою
Дослід1 – яйце в склянці з розчином з масовою часткою 10%
Дослід2 – яйце в склянці з розчином з масовою часткою 20%
Дослід 3 – яйце в склянці з розчином з масовою часткою 30%.
Зробимо висновки: Чим більше вміст солі у воді, тим
більше розчин буде виштовхувати предмет з води.
Домашнє завдання: заповнити таблицю, всі розрахунки запишіть нижче.
m(речовини), г
|
m (води), г
|
m (розчину), г
|
ω, %
|
|
1
|
30
|
170
|
||
2
|
50
|
100
|
||
3
|
5
|
95
|
||
4
|
150
|
15
|
||
5
|
400
|
25
|
||
6
|
200
|
18
|
16.04.20.
ТЕМА: Виготовлення розчинів.
Розв'яжіть задачі:
- 7г певної речовини розчинили у 34г спирту. Визначіть масову частку розчиненої речовини в розчині.
- Приготували 74г розчину, де масова частка солі становить 20%. Визначіть масу солі і води в розчині.
- Приготували 200г розчину, де цукру 5г. Визначіть масову частку води в розчині.
- До 40г розчину з масовою часткою розчиненої речовини 15% додали 80г розчину, де масова частка розчиненої речовини становить 20%. Обрахуйте масову частку розчиненої речовини в новоутвореному розчині.
17.04.20.
ТЕМА: Практична робота №5
ВИГОТОВЛЕННЯ ВОДНИХ РОЗЧИНІВ ІЗ ЗАДАНИМИ МАСОВИМИ
ЧАСТКАМИ РОЗЧИНЕНИХ РЕЧОВИН
Необхідно оформити практичну роботу на окремому подвійному аркуші наступним чином: не відкриваючи ваш аркуш по середині підписати Практична робота/ з хімії на тему/ Виготовлення водних розчинів із заданими масовими частками розчинених речовин/ учня(учениці) 7 класу/КЗШ №31/ прізвище ім'я в родовому відмінку.
Після чого відкриваємо ваш подвійний аркуш, на його лівій стороні записуємо дату (Сімнадцяте квітня). Нижче вам необхідно переписати мету, записати хід роботи. Далі ставите № задачі, повну умову не переписуйте, лише запишіть коротку умову (дано), розв'язуєте її. Після чого записати висновок, в якому дами відповідь на запитання: "Які знання необхідні вам, щоб правильно виготовити розчини із заданою масовою часткою?"
Фото своєї виконаної практичної роботи завантажте у форму за посиланням:
Мета:
навчитися виготовляти розчини із заданими масовими частками розчинених речовин;
закріпити вміння обчислювати
масу речовини й розчинника, необхідних для виготовлення розчину.
Хід роботи
1. Розв’яжіть задачу. До розчину масою 80 г з масовою часткою солі 15% долили 20 г води. Яка
масова частка утвореного розчину?
2. Розв’яжіть задачу. До 200 г розчину соди з масовою часткою Na2CO3 5%
додали ще 80 г соди. Якою стала масова частка соди в утвореному розчині?
3. Розв’яжіть задачу. Якщо змішати два розчини:
перший масою 230 г із масовою часткою калій йодиду (КІ) 5 %; другий масою 300 г
із масовою часткою калій йодиду 7%. То при цьому утвориться новий розчин із
масовою часткою калій йодиду?
ВИСНОВОК:
23.04.20., 30.04.20.
ТЕМА: Взаємодія води з оксидами.
Поняття про кислоти й основи.
Поняття про індикатори.
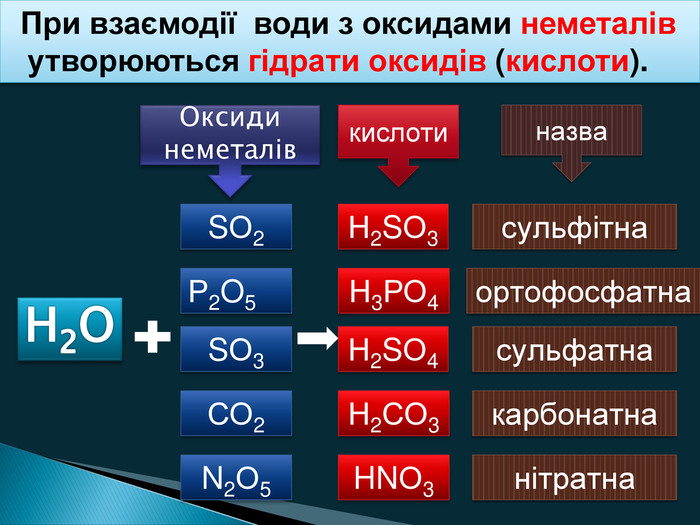
Більшість оксидів здатні вступати в хімічні реакції з водою. Зазвичай ці реакції є реакціями сполучення, у результаті яких утворюються продукти приєднання води до оксидів. Речовини, що утворюються сполученням води з іншими речовинами, називають гідратами.
Залежно від того, з яким оксидом взаємодіє вода, може утворитися два типи гідратів: кислоти і основи. Кислоти складаються з атомів Гідрогену і кислотного залишку (H2SO4, H2CO3), а у формулах основ на першому місці записують металічний елемент, з яким сполучається гідроксильна група —ОН (КОН, Ва(ОН)2). Залежно від гідрату, що відповідає певному оксиду, серед оксидів виділяють дві групи: кислотні оксиди та основні оксиди.
Кислотні оксиди
Усі кислотні оксиди, за винятком силіцій(ІV) оксиду SiO2, за звичайних умов вступають у реакції сполучення з водою з утворенням кислот, запишіть наступні рівняння реакції:
SO3 + Н2O = H2SO4 (сульфатна кислота)
СO2 + Н2O = Н2СO3 (карбонатна кислота)
Р2O5 + 3Н2O = 2Н3РO4 (ортофосфатна кислота)
Оксиди, гідрати яких є кислотами, називають кислотними оксидами.
Більшість кислотних оксидів — це оксиди неметалічних елементів. Але кислотні оксиди можуть утворювати і металічні елементи, якщо ці елементи можуть виявляти високі валентності, вищі за чотири. Так, до кислотних оксидів належать хром(VІ) оксид CrO3 та манган(VІІ) оксид Мn2O7.
Формули найбільш поширених кислотних оксидів та відповідних їм кислот наведено в таблиці 5.
Таблиця 5. Кислотні оксиди та відповідні їм кислоти
Кислотний оксид
|
Кислота (гідрат кислотного оксиду)
|
SiO2
|
Силікатна H2SiO3
|
SO2
|
Сульфітна H2SO3
|
P2O5
|
Ортофосфатна Н3РO4
|
N2O3
|
Нітритна HNO2
|
CrO3
|
Хроматна Н2СrO4
|
Mn2O7
|
Перманганатна НМnO4
|
Основні оксиди
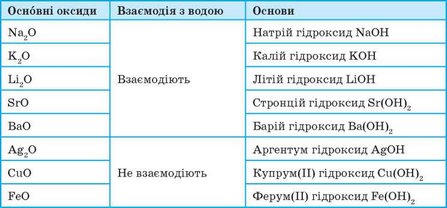
Продукти реакції оксидів із водою (гідрати) можуть виявляти основні властивості. Якщо гідрат оксиду є основою, то такий оксид є основним.
Оксиди, гідрати яких є основами (гідроксидами), називають основними оксидами.
До основних оксидів належать оксиди металічних елементів. Це здебільшого оксиди одно-, дво-, а іноді тривалентних металічних елементів (табл. 6).
Таблиця 6. Основні оксиди та відповідні їм основи
Основні оксиди
|
Взаємодія з водою
|
Основи
|
Na2O
|
Взаємодіють
|
Натрій гідроксид NaOH
|
K2O
|
Калій гідроксид КОН
| |
Li2O
|
Літій гідроксид LiOH
| |
SrO
|
Стронцій гідроксид Sr(OH)2
| |
ВаО
|
Барій гідроксид Ва(ОН)2
| |
Ag2O
|
Не взаємодіють
|
Аргентум гідроксид AgOH
|
CuO
|
Купрум(ІІ) гідроксид Сu(ОН)2
| |
FeO
|
Ферум(ІІ) гідроксид Fe(OH)2
|
Більшість основних оксидів із водою не взаємодіють. У реакцію з водою вступають лише оксиди, гідрати яких розчиняються у воді. Такі гідрати називають лугами (запишіть рівняння реакції):
Na2O + Н2O = 2NaOH
СаО + Н2O = Са(ОН)2
Виявлення кислот і основ у розчинах
Більшість оксидів і відповідних їм гідратів — безбарвні сполуки, тому визначити їх наявність або розрізнити кислоти й основи без «сторонньої допомоги» неможливо. Для виявлення кислот і основ у розчинах використовують індикатори — складні органічні сполуки, що змінюють своє забарвлення залежно від наявності кислоти або основи в розчині. Найпоширеніші індикатори та їхній колір за наявності кислот та основ наведено в таблиці 7.

Забарвлення лакмусу: а — за наявності кислот;
б — основ
Таблиця 7. Забарвлення деяких індикаторів за наявності кислот і основ та у воді
Індикатор
|
Забарвлення
| ||
у розчинах кислот
|
у розчинах основ
|
у чистій воді
| |
Лакмус
|
Червоний
|
Синій
|
Фіолетовий
|
Метилоранж
|
Червоний
|
Жовтий
|
Оранжевий
|
Фенолфталеїн
|
Безбарвний
|
Малиновий
|
Безбарвний
|
Здебільшого індикатори використовують у вигляді розчинів — у воді або в спирті. Зручніше використовувати індикаторний папір — звичайний папір, просочений розчином індикатору, а потім висушений. У продаж він потрапляє у вигляді набору тоненьких смужечок.

Розчин індикатору та індикаторний папір
Домашня робота:
1) Із наведеного переліку випишіть в окремі стовпчики формули оксидів: а) кислотних; б) основних. Na2O, Р2O5, СO2, SO3, CrO, Cu2O, SiO2, Мn2O7.
2) Гасіння вапна — це взаємодія негашеного вапна (кальцій оксиду) з водою. Складіть рівняння цієї реакції.
3) Доповніть схеми реакцій і назвіть продукти реакції:
а) Lі2O + Н2O —> ......;
б) SO2 + Н2O —> ......;
в) ...... + Н2O —> Ва(ОН)2.
07.05.20.
Тема: Значення води і водних розчинів у
природі та житті людини.
"Аguа" в перекладі з латинської мови
означає "вода". Як алфавіт починається з букви "а", так
життя починається з води. Вода міститься в кожній людині, тварині і рослині і йде
з них тільки разом із життям. Ось чому девіз уроку "Вода - це
життя!". Ото ж
сьогодні ми проведемо розмову про добре відому, а водночас і найзагадковішу речовину - воду. Наша мета - з'ясувати її роль у нашому житті.
Здавалося б, що нового і
цікавого можна дізнатися про один з найважливіших мінералів Землі - про воду? Ми занадто звикли до води, занадто звичні
для нас дощ, течії річок, гладь озер і морів.
Життя на Землі зародилося з води. Вона стала первинним середовищем для еволюції органічного світу і входить до складу всіх живих істот. Очевидно звідси і походять вислови "Вода - чудо
природи", "Вода - еліксир життя". Воду вивчають фізики, біологи, географи. Не менш важливою є вода і для хімії.
Вчені вважають, що було б правильніше назвати нашу планету - Вода, оскільки її поверхня на 2/3 вкрита водою. Уявітъ собі, щоб відбулося, якби вода зникла з нашої планети? Пересохли б всі річки, озера, з'явилися б сумні днища морських і океанських западин, вкриті товстим шаром солі. Ні рослини, ні тварини, жодної людини на Землі... Мертва планета, як і всі інші планети Сонячної системи.
Водну оболонку Землі називають гідросферою. Гідросферу складають води світового
океану (96.5%), поверхневі та підземні води (3,5%), вода в атмосфері ( менше
1%). Значні запаси води (24 млн.м3.) містять льодовики. Підраховано, що в Світовому океані міститься 1370млн.км3 води.
Доступна для наземних організмів вода складає невелику частку від її
загальної кількості всього біля 0,01%. Вода океанів могла б покрити всю земну
кулю шаром товщиною 2700м, вода річок і озер - в 0,4м, вода атмосферної пари –
в 3 см .
Вода входить до складу
комет, більшості
планет Сонячної
системи та їх супутників. Молекули води виявлено навіть у міжзоряному просторі.
Вода - це особлива
речовина. Про те, що вона може перебувати у трьох агрегатних станах знав ще
грецький філософ
Фалес із Мілета в VI ст. до нашої ери.
Завдяки таким фізичним властивостям, вода знаходиться у вічному русі. Малий її колоообіг: океан - атмосфера - суша – океан.

Сьогодні будь-який школяр без зусиль назве формулу
води Н2О.
Вода - найцінніший скарб планети Земля. Її значення важко оцінити. Рослини, тварини,
людина не можуть існувати
без води. Вода входить до складу їхніх організмів. Наприклад, у дорослої людини вода становить 2/3 маси тіла, а новонародженої - 3/4. Кров людини містить 90% води, серце і мозок приблизно 80%, кістки -30%.
Кожна людина повинна стежити за тим,
щоб в її організм надходила достатня кількість води. Для вашого віку добова
норма води становить 1,5—2 л.
Щоб розрахувати необхідну кількість води для себе, треба масу тіла*0,033=ваша норма води за добу.
Знаючи
масу власного тіла, розрахуємо кількість води у своєму організмі: m(Н2О)
= 0,65 • m(тіла).
Цікаво зазначити, що в тілі медузи 98% води, в огірках -98%, а в картоплі -77%. Вода входить до складу мінералів, як на поверхні землі, так і в глибинах.
Усі фізіологічні процеси в живих
організмах відбуваються при наявності води: регуляція температури тіла,
транспортна функція крові, очищення організму від шлаків та інші.
Значення
водних розчинів у природі та житті людини
Із розчинами, розчиненням
речовин у воді ми постійно зустрічаємося в природі та побуті. Для живлення
рослин необхідно, щоб поживні речовини ґрунту були розчинені у воді. У морській
воді розчинені у великій кількості солі, тому вона на смак солоно-гірка.
Розчинами є малярні фарби, парфуми, багато ліків виготовляються у вигляді
розчинів. Приготування їжі, прання білизни, миття посуду також не можливе без
води.
Розчини й сам процес
розчинення мають велике значення в природі, у нашому житті, у науці й техніці.
Найчастіше ми маємо справу не з чистими речовинами, а із сумішами або
розчинами. Вода морів, річок, озер, ґрунтові води, питна вода — це розчини.
Повітря — це розчин газів. Більшість мінералів — це тверді розчини. Соки
рослин, напої — це розчини. Засвоєння їжі пов'язане з розчиненням поживних
речовин. Розчинами є кров, лімфа, ліки, лаки, фарби. Розчини використовуються в
промисловості: текстильній, металообробній, фармацевтичній, при виробництві
пластмас, синтетичних волокон, мила та ін.
Шкідлива дія води
Вода є також одним з найважливіших геологічних факторів, що змінює
зовнішній вид земної поверхні, розмиваючи гори і утворюючи долини. Вона руйнує гірські породи не тільки механічно, а й хімічно, реагуючи з
ними з утворенням інших речовин. До
шкідливих дій води відносяться явища і процеси, які відбуваються при прямій або
побічній участі води і наносять збиток навколишньому середовищу, населенню або
господарським об’єктам.
Шкідливими діями вод є:
· повені,
що призвели до затоплення і підтоплення земель та населених пунктів;
· аварії
гідротехнічних споруд;
· руйнування
берегів, захисних дамб та інших споруд;
· заболочення, підтоплення і засолення
земель, спричинені підвищенням рівня ґрунтових вод внаслідок ненормованої
подачі води під час зрошення, створення ставків та водосховищ, витікання води з
водопровідно-каналізаційних систем тощо;
· селеві
потоки;
· затоплення
і підтоплення земель в районах видобування корисних копалин, а також після
закінчення експлуатації родовищ та їх консервації;
· водна
ерозія ґрунтів;
· утворення
ярів, зсувів, карстових воронок тощо.
Кислотні дощі
Вода взаємодіє як з простими, так і з складними
речовинами. Взаємодія з оксидами неметалічних елементів (кислотними оксидами), а саме з оксидами
сульфуру та нітрогену призводить до утворення кислотних дощів.
Перегляньте будь ласка відео, в якому розповідається про причини кислотних дощів та їх наслідки для навколишнього середовища. ( рН - показник кислотності середовища, рН=7 це нейтральне середовище, рН<7 - кисле середовище, рН>7 - лужне середовище).
Воду потрібно берегти! Піклуючись про чистоту води,
ми піклуємося про своє здоров'я, красу навколишньої природи. У нашій країні
прийнято низку законів, спрямованих на захист вод. За їх виконанням стежать
органи державної влади, екологи. Щороку,
22 березня відзначається Всесвітній день
води. Щорічно в цей день проголошується та чи інша задача по забезпеченню людей
всього світу водою, вирішуються найважливіші питання та проблеми, пов'язані
нею.
Обрати одну тему з переліку та підготувати проект у вигляді електронної презентації чи роботі на арукуші формату А4/А3 з малюнками, ілюстраціями (фото) та короткою інформацією з обраної теми. Презентацію чи фото вашої роботи надістати за електронною адресою narina0596@gmail.com.
1) Зберігаючи воду - заощаджую родинний бюджет ( можна підрахувати кошти, які заощадите при економії води).
2) Дослідження фізичних та хімічних властивостей води.
3) Способи очищення води в побуті.
4) Збереження чистоти водойм: розв'язування проблеми у нашій місцевості.
14.05.20.
ТЕМА: Представлення результатів
навчальних проектів.
Обрати одну тему з переліку та підготувати проект у вигляді електронної презентації чи роботі на арукуші формату А4/А3 з малюнками, ілюстраціями (фото) та короткою інформацією з обраної теми. Презентацію чи фото вашої роботи надістати за електронною адресою narina0596@gmail.com.
1) Зберігаючи воду - заощаджую родинний бюджет ( можна підрахувати кошти, які заощадите при економії води).
2) Дослідження фізичних та хімічних властивостей води.
3) Способи очищення води в побуті.
4) Збереження чистоти водойм: розв'язування проблеми у нашій місцевості.
15.05.20.
ТЕМА: Контрольна робота з теми
"Кисень. Вода".
21.05.20.
ТЕМА: Повторення. Взаємодія
кисню з простими та складними
речовинами. Взаємодія оксидів з
водою.
За звичайних умов кисень реагує з обмеженим числом речовин, але з підвищенням температури він реагує майже з усіма металами, а також більшістю неметалів, утворюючи складні речовини – оксиди:
Е – умовний символ неметалічного елемента (S, P, N, H, Si, C);
Ме – умовний символ металічного елемента (K, Na, Zn, Ba, Mg, Fe, Al, Li, Ca та інші).
Дослідимо хімічні властивості кисню.
1. Взаємодія кисню з неметалами
1.1. Взаємодія кисню з фосфором (Р)
Оскільки, валентність Фосфору – V, а Оксигену – II, то формула оксиду – P2O5. Рівняння реакції матиме такий вигляд:
4Р + 5О2 = 2Р2О5 (фосфор(V) оксид).
1.2. Взаємодія кисню з вугіллям (С)
С + О2 = СО2 (карбон(ІV) оксид).
1.3. Взаємодія кисню із сіркою (S)
Сірка розгоряється гарним, синім полум’ям, при цьому утворюється газ із різким запахом – сульфур(IV) оксид:
S + O2 = SO2 (сульфур(ІV) оксид).
2. Взаємодія кисню з металами
Кисень взаємодіє з металами. Одні метали в кисні горять як от залізо, магній, а інші – окиснюються.
2.1. Взаємодія кисню з магнієм (горіння магнію)
магній горить на повітрі яскравим засліплюючим полум’ям з виділенням теплоти і світла. Цю реакцію використовують у фейєрверках.
2.2. Взаємодія міді й алюмінію з киснем
Мідна спіраль у кисні розжарюється, але не горить, а покривається чорним нальотом купрум(ІІ) оксиду: 2Cu + O2 = 2CuO (купрум(ІІ) оксид).
На відміну від міді, алюміній реагує з киснем навіть без нагрівання, з утворенням на своїй поверхні надзвичайно тонкої та стійкої оксидної плівки: 4Al + 3O2 = 2Al2O3 (алюміній оксид).
Аналогічно взаємодіють з киснем й інші прості речовини. Хімічні реакції кисню з простими речовинами відносять до реакцій окиснення, а утворені речовини – до оксидів.
Під час взаємодії кисню з простими речовинами відбувається сполучення їхніх структурних частинок з молекулами кисню:
3. Взаємодія кисню зі складними речовинами
3.1.
За певних умов у кисні горять складні речовини:
Під час взаємодії складних речовин з киснем утворюються оксиди тих хімічних елементів, які входили до складу складної речовини.
Прикладом взаємодії кисню зі складними речовинами може бути горіння природного газу метану (СН4). При цьому утворюються дві речовини – вуглекислий газ і вода:
СН4 + 2О2 = СО2 + 2Н2О.
3.2.
У деяких випадках під час горіння складних речовин можуть утворюватися оксиди і прості речовини:
4NH3 (амоніак) + 3O2 = CO2 + 2H2O .
3.3.
Кисень взаємодіє з деякими оксидами. Це реакція сполучення. Продуктом такої реакції є інший оксид, у якому елемент виявляє вище значення валентності:
2CO + O2 = 2CO2;
2SO2 + O2 = 2SO3.
2SO2 + O2 = 2SO3.


Домашнє завдання:
1) З поданого переліку формул речовин випишіть формули оксидів та назвіть їх:
SO3, HNO3, SO2, KCl, NO2, Zn(OH)2, N2O5, CuO, Cu(NO3)2, HgO.
SO3, HNO3, SO2, KCl, NO2, Zn(OH)2, N2O5, CuO, Cu(NO3)2, HgO.
2) Напишіть рівняння реакцій, які відповідають таким схемам:
| а) O2 + ? → ZnO; K + ? → K2O; N2 + ? → NO; | б) CH4 + ? → CO2 + H2O; CuS + ? → CuO + SO2; Fe + ? → Fe3O4; |
28.05.20.
ТЕМА: Розв'язок задач.
1) Обчисліть масу кухонної солі, яку необхідно взяти для приготування розчину масою 250 г із масовою часткою 5 %.
2) Обчисліть маси цукру і води, необхідні для приготування розчину масою 500 г з масовою часткою цукру 3 %.
3) Обчисліть масові частки всіх елементів у сполуках із такими хімічними формулами; a) NО2; б) РbСl2; в) Nа2СO3
29.05.20.





















Комментариев нет:
Отправить комментарий